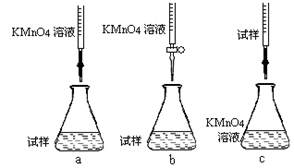
-
下列说法正确的是
A.目前,我国城市环境污染中的大气污染物包括SO2、NO2、CO、烟尘等
B.石油的分馏、煤的干馏都是化学变化
C.赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色
D.绿色化学的核心是应用化学原理对环境污染进行治理
难度: 中等查看答案及解析
-
下列说法正确的是
A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂
B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子
C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸
D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+
难度: 中等查看答案及解析
-
下列说法正确的是
A.NaHCO3和Na2CO3混合溶液中,一定有
c(Na+)+c(H+)=c(OH-)+c(HCO3-) +c(CO32-)
B.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为
NaOH>Na2CO3>NaHSO4>(NH4)2SO4
C.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1∶2
难度: 中等查看答案及解析
-
下列实验操作、现象或反应原理的解释、结论均正确的一组是
操作、现象 解释或结论
A.铝箔在酒精灯火焰上加热,熔化但不滴落 铝箔对熔化的铝有吸附作用
B.向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 增大反应物的浓度,化学平衡向正反应方向移动
C.向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热,未见红色沉淀 淀粉未水解
D.取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 该溶液中一定含有大量的SO42-
难度: 中等查看答案及解析
-
下列说法正确的是

图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.图I所示装置用于Cu和浓H2SO4制取少量的SO2气体
B.图Ⅱ装置可验证非金属性:Cl>C>Si
C.图Ⅲ可用于收集气体H2、CO2、Cl2、NH3
D.图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化
难度: 中等查看答案及解析
-
用如图所示装置进行实验,下列叙述不正确的是
A.K与N连接时,铁被腐蚀
B.K与N连接时,石墨电极产生气泡
C.K与M连接时,一段时间后溶液的pH增大
D.K与M连接时,石墨电极反应:4OH- - 4e- = 2H2O + O2↑
难度: 中等查看答案及解析
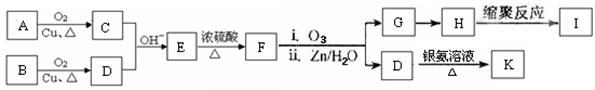
 (﹣R、﹣R’表示氢原子或烃基)
(﹣R、﹣R’表示氢原子或烃基)


 试回答:
试回答: