-
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.氮氧化合物与碳氢化合物经紫外线照射可发生反应形成有毒烟雾
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.雾霾中含有大量超标的主要物质是二氧化硫
D.食盐中的Na+的焰色反应呈黄色,属于化学变化
难度: 中等查看答案及解析
-
下列解释事实的离子方程式正确的是
A.铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3- =Fe3+ + NO↑+ 2H2O
B.向Ca(ClO)2溶液中通入过量CO2制取次氯酸: 2ClO- + H2O + CO2 =2HClO + CO32
C.向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O
D.0.01 mol·L—1 NH4Al(SO4)2溶液与0.02 mol·L—1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH—=2BaSO4↓+Al(OH)3↓+NH3·H2O
难度: 中等查看答案及解析
-
某些化学知识用数轴表示能体现出形象直观、简明易记的特点。下列用数轴表示不合理的是
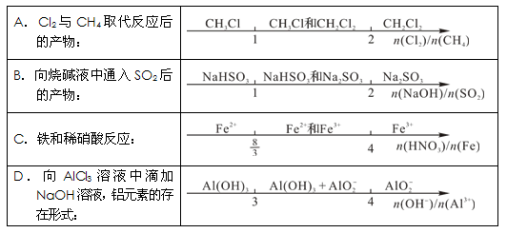
难度: 困难查看答案及解析
-
下列有关溶液中微粒的物质的量浓度关系正确的是
A.某弱酸的酸式盐NaHA溶液中一定有:c(OH﹣)+2c(A2﹣)=c(H+)+c(H2A)
B.0.1 mol•L﹣1 CH3COONa溶液与0.05 mol•L﹣1盐酸等体积混合后的酸性溶液中:c(Cl﹣)>c(CH3COO﹣)>c(CH3COOH)>c(H+)
C.物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN﹣)+2c(OH﹣)=2c(H+)+c(HCN)
D.0.1 mol•L﹣1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L﹣1
难度: 困难查看答案及解析
-
阿伏加德罗常数用NA表示,下列叙述正确的是
①22g T2O含有电子数为10 NA
②0.44gC3H8中含有的σ键总数目为0.1NA
③1 mol Na2O2与CO2完全反应时转移电子数为2NA
④28 g 硅晶体中含有2 NA个Si—Si键
⑤11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑥200 mL,1 mol/L Al2(SO4)3溶液中,Al3+和SO42-离子数的总和是NA
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3 NA
⑧O2和O3的混合物共6.4g,其中所含原子数一定为0.4 NA
A.①②③⑤⑧ B.②④⑥⑦⑧ C.①③⑤⑥⑦ D.①②④⑧
难度: 困难查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
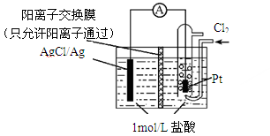
A.正极反应为Ag-e-=Ag+
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.当电路中转移0.1mol e-时,通过交换膜的阳离子为0.2mol
D.用KCl溶液代替盐酸,则电池总反应不改变
难度: 困难查看答案及解析
-
已知:2Fe2++Br2===2Fe3++2Br-,2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是
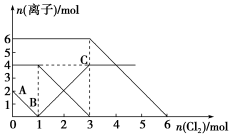
A.还原性:I->Fe2+>Br-
B.原混合溶液中FeBr2的物质的量为6 mol
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
难度: 极难查看答案及解析


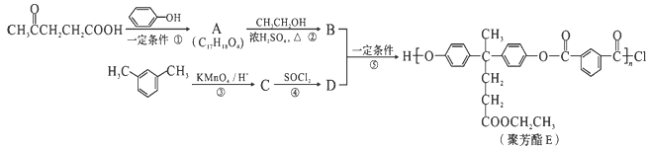
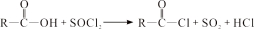
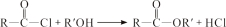 (R、R′表示烃基)
(R、R′表示烃基)