-
下列各反应中,生成物总能量比反应物总能量高的是
A.工业合成氨 B.铁生锈 C.木炭燃烧 D.电解饱和食盐水
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)=2C(g)+D(g),经2 min后,B的浓度减少了0.6mol/L。下列反应速率的表示正确的是
A.用A表示的反应速率是0.4 mol/(L·min)
B.用B表示的反应速率是0.3 mol/(L·min)
C.2 min末时的反应速率,用B表示是0.3 mol/(L·min)
D.在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大
难度: 中等查看答案及解析
-
在水溶液中,因发生水解反应而不能大量共存的一组离子是
A.CO32-、OH-、Na+、H+ B.Al3+、Na+、AlO2-、Cl-
C.Ba2+、HCO3-、K+、SO42- D.S2-、H+、SO42- 、Cu2+
难度: 中等查看答案及解析
-
下表中物质的分类组合正确的是
A
B
C
D
强电解质
Al2(SO4)3
BaSO4
HF
KClO3
弱电解质
H3PO4
H2O
CaCO3
Al(OH)3
非电解质
CO2
NH3·H2O
NH3
HI
难度: 中等查看答案及解析
-
根据如图所示的反应判断下列说法中错误的是

A.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B.该反应的焓变大于零
C.该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
难度: 中等查看答案及解析
-
25°C时,水的电离达到平衡:H2O
H++OH-,下列叙述正确的是
A.将纯水加热到95°C时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加人少量碳酸钠固体,c(H+)减小,Kw不变,影响水的电离平衡
D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变
难度: 中等查看答案及解析
-
下列离子方程式属于盐的水解,且书写正确的是
A.NaHCO3溶液:HCO3-+H2O
CO32-+H3O+
B.NaHS溶液:HS-+H2O
H2S+OH-
C.Na2CO3溶液:CO32- +2H2O
H2CO3+2OH-
D.NH4Cl溶于D2O中:NH4++D2O
NH3·D2O+H+
难度: 中等查看答案及解析
-
下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是
A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫
C.厨房中常用碳酸钠溶液洗涤餐具上的油污
D.可用碳酸钠与醋酸制取少量二氧化碳
难度: 困难查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH-(aq)=H2O(l);△H= -57.3kJ·mol-1。已知:醋酸电离要吸热。稀醋酸、浓硫酸、稀硝酸分别与0.1mol·L-1的NaOH溶液恰好完全反应放出的热量关系如图所示。则下列描述正确的是
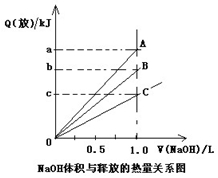
A.A表示稀硝酸与NaOH溶液反应
B.B表示稀醋酸与NaOH溶液反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液反应
难度: 困难查看答案及解析
-
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离平衡常数,若已知下列反应可以发生:NaCN + HNO2
HCN + NaNO2
NaCN + HF
HCN + NaF NaNO2 + HF
HNO2 + NaF由此可判断下列叙述不正确的是
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序为:HF>HNO2>HCN
D.K(HCN)<K(HNO2)<K(HF)
难度: 困难查看答案及解析
-
能源短缺是全球面临的问题,用CO2来生产燃料甲醇的反应原理为
CO2(g)+3H2(g)
CH3OH(g)+H2O(g) 已知某些化学键的键能数据如表所示:
化学键
C-H
H-H
C-O
C=O
H-O
键能/kJ·mol-1
413.4
436.0
351.0
745.0
462.8
则该反应的焓变△H为
A.-46.2 kJ· mol-1 B.+46.2 kJ· mol-1
C.-181.6 kJ· mol-1 D.+181.6 kJ· mol-1
难度: 中等查看答案及解析
-
已知298 K下反应2Al2O3(s)+3C(s)===4Al(s)+3CO2(g) ΔH=+2 171 kJ/mol,
ΔS=+635.5 J/(mol·K),则下列说法正确的是
A.由题给ΔH值可知,该反应是一个放热反应
B.ΔS>0表明该反应是一个熵增加的反应
C.该反应在室温下可能自发
D.不能确定该反应能否自发进行
难度: 中等查看答案及解析
-
将一定量A、B装入容积为1 L的恒温密闭容器中,发生反应:2A(g)+mB(g)
nC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的1/2,达到新的平衡时C的浓度为1.8 x mol·L-1,下列说法正确的是
A.化学计量数的关系为2+m>n
B.容器的容积缩小,正反应速率增大,逆反应速率减小
C.原容器中用B表示的该反应在1 min内的平均速率为
mol·(L·min)-1
D.若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动
难度: 困难查看答案及解析
-
下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是

A.石墨转变为金刚石是吸热反应
B.S(g)+O2(g) = SO2(g) ΔH1;S(s)+O2(g) = SO2(g) ΔH2。则ΔH1>ΔH2
C.白磷比红磷稳定
D.CO(g)+H2O(g) = CO2(g)+H2(g) ΔH>0
难度: 中等查看答案及解析
-
以NA代表阿伏加德罗常数,则关于反应:C2H2(g)+
O2(g) =2CO2(g)+H2O(1);△H=-1300kJ/mol下列说法中,正确的是
A.有10NA个电子转移时,该反应吸收1300kJ的能量
B.有NA个水分子生成且为液态时,吸收1300kJ的能量
C.有NA个碳氧共用电子对形成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对形成时,放出1300kJ的能量
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是
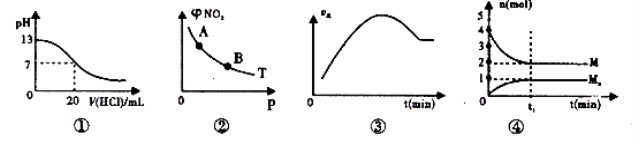
A.图①表示室温时,用0.1 mol.L-1 盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化
B.T℃时,反应2NO2(g)
N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅
C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应
2A2(g)+B2(g)
2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g)
Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时
将增大
难度: 极难查看答案及解析
-
相同条件下,在①pH=2的CH3COOH溶液、②pH=2的HCl溶液、③pH=12的氨水、④pH=12的NaOH溶液中,下列说法不正确的是
A.水电离的c(H+):①=②=③=④
B.等体积的①、②分别与足量铝粉反应,生成H2的量:②>①
C.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③
D.将四种溶液分别稀释100倍后,溶液的pH:③>④>②>①
难度: 中等查看答案及解析
-
在容积相同的五个密闭容器中分别放入等量的A2和B2,在不同温度下同时任其发生反应:A2(g)+3B2(g)
2AB3(g),分别在某一相同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是
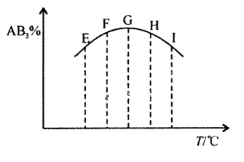
A.正反应是放热反应
B.E、F二点尚未达到平衡
C.H、I二点尚未达到平衡
D.G、H、I三点已达平衡状态
难度: 中等查看答案及解析
-
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定25.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)=10—5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)>c(Y—)>c(OH—)>c(H+)
D.HY与HZ混合,达到平衡时:

难度: 极难查看答案及解析
-
25℃时体积为1L浓度为0.15mol·L-1的NaOH溶液充分吸收2.24LCO2(标准状况),温度恢复到25℃。下列有关上述反应后溶液的说法及关系正确的是
A.反应过程中CO2过量,溶液的pH<7
B.水的离子积常数Kw<10-14
C.2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
难度: 困难查看答案及解析

