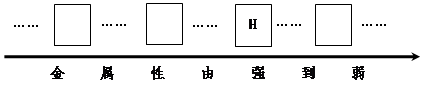
-
将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是( )
A.Mn、Mg、Cu B.Mg、Mn、Cu C.Cu、Mg、Mn D.Cu、Mn、Mg
难度: 中等查看答案及解析
-
铁制品在通常情况下很易生锈,制造时往往在铁制品表面电镀一层铜起防锈作用。下列说法正确的是( )
A.镀铜铁制品不可以在弱酸性条件下使用 B.镀铜铁制容器可盛硝酸银溶液
C.镀铜铁制品不易生锈的原因之一是使铁隔绝了空气 D.镀铜铁制品是一种合金
难度: 中等查看答案及解析
-
芯片是电脑、“智能”加点的核心部件,它是用高纯度硅制成的。下面是生产单质硅过程中的一个重要反应:SiO2 + 2C 高温 Si +2CO↑,该反应的基本类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
难度: 中等查看答案及解析
-
“金银铜铁锡”俗称五金。在这五种金属中,有一种金属与其他四种金属的盐溶液都能发生反应,这种金属是( )
A.金 B.铜 C.铁 D.锡
难度: 中等查看答案及解析
-
光亮的铁钉在下列几种情况下,最不容易生锈的是( )
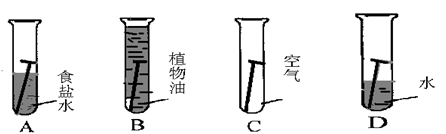
难度: 中等查看答案及解析
-
下列四个实验中只需要完成三个就可以证明Fe、Cu、Ag三种金属的活动性顺序。其中不必进行的是( )
A.将铁片放入稀盐酸 B.将铜片放入稀盐酸
C.将铁片放入硝酸银溶液 D.将铜片放入硝酸银溶液
难度: 中等查看答案及解析
-
铝在一百多年里产量得到大幅度的提高,并被广泛地使用,原因之一就是铝的抗腐蚀性能好。铝具有良好抗腐蚀性能的原因是( )
A.铝的化学性质不活泼 B.铝不与酸、碱反应
C.铝常温下不与氧气反应 D.铝表面生成一层致密的氧化铝保护膜
难度: 中等查看答案及解析
-
通过置换反应可判断金属活动性顺序,某同学通过实验来比较铜、铝、汞的金属活动性顺序,现有铜、铝、汞的三种单质,如果另外只用一种试剂达到实验目的,则应选用下列试剂中的( )
A.稀硫酸 B.氯化铝溶液 C.硝酸汞溶液 D.硫酸铜溶液
难度: 中等查看答案及解析
-
下列叙述的用途中,与氮气化学性质不活泼无关的是
A.食品包装时充氮气以防腐
B.焊接金属时常用氮气作保护气
C.灯泡中充氮气以延长使用寿命
D.用氮气制硝酸和氮肥
难度: 中等查看答案及解析
-
在一定条件下,下列转化不能由一步反应实现的是( )
A.Fe2O3→FeCl2 B.H2CO3→CO2 C.CuCl2→Cu D.Mg→MgO
难度: 中等查看答案及解析
-
有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放人硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )
A.Z、Y、X B.X、Y、Z C.Y、X、Z D.X、Z、Y
难度: 中等查看答案及解析
-
废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,为了回收重金属,将旧手机的部件粉碎并浸入足量稀硫酸中充分反应过滤,所得固体中含有的金属是( )
A.Mg、Al B.Cu、Ag C.Al、Cu D.Mg、Ag
难度: 中等查看答案及解析
-
相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。下列叙述正确的是 ( )
A.金属的活泼性N>M B.两个反应生成H2的体积相等
C.相对原子质量N>M D.两个反应消耗盐酸的质量一定相等
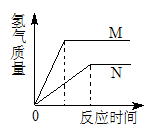
难度: 中等查看答案及解析
-
如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左
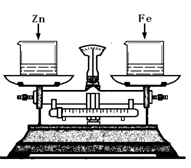
难度: 中等查看答案及解析