-
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
序号
不纯物
除杂试剂
分离方法
A
CH4(C2H4)
酸性KMnO4溶液
洗气
B
苯(苯酚)
浓溴水
过滤
C
C2H5OH(H2O)
新制生石灰
蒸馏
D
乙醇(乙酸)
饱和Na2CO3溶液
分液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A. 甲的分子数比乙的分子数多
B. 甲的物质的量比乙的物质的量小
C. 甲的摩尔体积比乙的摩尔体积小
D. 甲的相对分子质量比乙的相对分子质量小
难度: 中等查看答案及解析
-
化学与生活密切相关,下列有关说法错误的是
A. 新能源汽车的推广与使用,有助于减少光化学烟雾的产生
B. 普通玻璃是由纯碱、石灰石和石英制得的
C. 高纯度的SiO2是制备光导纤维、太阳能电池板的主要材料
D. 海带中碘元素确定的实验主要步骤骤是:前期处理-灼烧-溶解-氧化-淀粉溶液检验
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 二氧化氯可用于自来水的杀菌消毒
B. 铝制餐具不宜用来蒸煮或长时间存放咸的食物
C. 把固体炸药制成胶体能提高威力
D. 做焰色反应时透过蓝色钴玻璃观察到紫色的现象说明待测液中一定含有钾盐
难度: 简单查看答案及解析
-
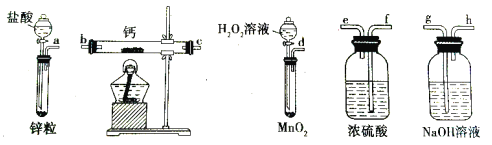
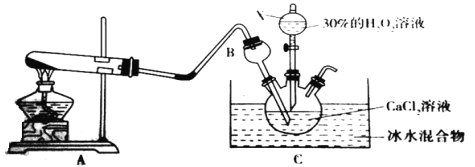
下列实验装置及操作正确的是

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4
2CO2+3N2+4H2O
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①向硅酸溶胶中逐渐滴加氢氧化钠至过量 ②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2溶液投入到过量NaHCO3溶液中 ④向NaAlO2中滴入NaHCO3溶液
⑤向饱和Na2CO3溶液中通入足量CO2 ⑥氯化钙溶液中通入少量的CO2
A. ①②③④⑤ B. ③④⑤⑥ C. 只有③④⑥ D. 只有③④⑤
难度: 中等查看答案及解析
-
2017年5月9日发布了113号Nh、115号Mc、117号Ts、118号Og这4种新元素的中文名称,分别为
、“镆”(mò)、
(tián)、
(ào)。下列有关说法正确的是
A. 115号元素在周期表中的位置是第七周期VB
B. 这四种元素都是主族元素
C. 118号元素在通常情况下呈气态,其余三种为固态
D. 117号元素Ts位于金属非金属分界线上,可能是半导体,与它同族的上一周期元素的原子序数为99
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
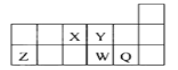
A. 元素X与元素Z的最高化合价之和的数值等于8
B. 原子半径的大小顺序为r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 可以通过电解Z元素的氯化物得到Z单质
D. 元素Q的氧化物对应水化物的酸性一定比W的强
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确有( )个
①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子
②0℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移
③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA
④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶体数目为NA
⑤同温同压下,O2和CO组成的混合气体的密度是氢气的15倍,则O2和CO的体积比1:1
⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
⑧100克质量分数为46%的乙醇溶液中,含有的氧原子数目为4NA
⑨标准状况下,22.4LHF气体中含有NA个气体分子
A. 4 B. 1 C. 2 D. 3
难度: 中等查看答案及解析
-
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之—。对下列反应实验现象的推断或解释正确的是.
选项
操作
实验现象
解释
A
向某钾盐中滴加浓盐酸,产生气体再通入品红溶液
品红溶液褪色
该钾盐为K2SO3或KHSO3
B
铝热剂溶于足量稀盐酸再滴加KSCN溶液
出现血红色
铝热剂中一定含有氧化铁
C
将少量溴水加入KI溶液中,再加入
CCl4,振荡,静置
下层液体呈紫色
氧化性:Br2>I2
D
将足量过氧化钠固体投入紫色石蕊试液中
溶液变成蓝色
过氧化钠与水反应生成氢氧化钠,溶液呈碱性
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
碱性锌锰电池的反应方程式为: 2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2,其构造如图所示。有
关说法不正确的是
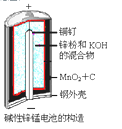
A. 负极反应式:Zn+2OH--2e-=Zn(OH)2
B. 放电时正极MnO2得到电子,发生氧化反应
C. 该电池使用一段时间后,电解液pH增大
D. 放电时,锌粉失去的电子,从负极通过外电路流向正极
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列说法正确的是
A. 电解饱和食盐水,阳极的电极反应式为2Cl--2e-=Cl2↑
B. 外加电流的金属保护中,被保护的金属与电源的正极相连,发生氧化反应
C. 粗铜精炼时,与电池正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D. 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
下列说法中正确的个数是
①Na2O、Fe2O3、Al2O3属于碱性氧化物,CO2、SO2都能和碱溶液发生反应属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉主要成分之一,Na2CO3可治疗胃酸过多。
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A. 5 B. 4 C. 2 D. 3
难度: 中等查看答案及解析
-
下列离子方程式的书写及评价,均合理的是
选项
离子方程式
评价
A
将2mol Cl2通入到含lmol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
正确:Cl2过量,可将Fe2+、I-均氧化
B
Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3-+OH-=BaCO3↓+H2O
正确:酸式盐与碱反应生成正盐和水
C
过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3-
正确:说明酸性:H2SO3强于HC1O
D
lmol/L的NaA1O2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3+++Al(OH)3↓+H2O
正确:AlO2-与H+均无剩余
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
①pH=0的溶液:Na+、Cl-、 MnO4-、SO42-
②pH=l1的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度c(H+)=l0-12mol·L-1的溶液中,Cl-、CO32-、NO3-、NH4+、SO32-
④加入 Mg 能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2-
A. ②④ B. ①③⑥ C. ①②⑤ D. ①②⑥
难度: 中等查看答案及解析
-
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是
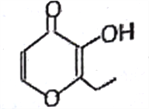
A. 该有机物分子式为:C7H10O3
B. 该有机物所有质子可能在同—平面
C. 该有机物能发生取代、加成、氧化、还原反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
难度: 中等查看答案及解析
-
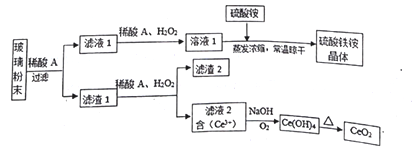
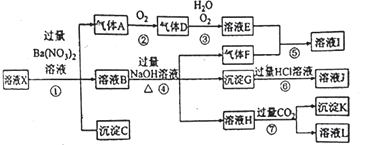
根据如图的转化关系判断下列说法正确的是(反应条件已略去)

A. 反应①②③④⑤均属于氧化反应和离子反应
B.反应⑤说明该条件下铝的还原性强于锰
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应①中氧化剂与还原剂的物质的量之比为1:4
难度: 中等查看答案及解析