-
下列说法不正确的是( )
A.需要加热才能发生的反应不一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应放热还是吸热
D.吸热反应在一定条件下(如常温、加热等)也能发生反应
难度: 简单查看答案及解析
-
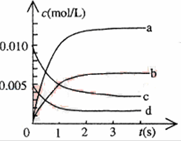
已知:(1)
=H2O(g) △H1=a kJ·
(2)
=2H2O(g) △H2=b kJ·
(3)
=H2O(l) △H3=c kJ·
(4)
=2H2O(l) △H4=d kJ·
下列关系式中正确的是 ( )
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 简单查看答案及解析
-
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
难度: 简单查看答案及解析
-
在pH=13的无色溶液中,可以大量共存的一组离子是:( )
A.NH4+、NO3— 、K+、SO42— B.CO32_、NO3—、Al3+、Na+
C.Na+、ClO—、AlO2—、NO3— D.CrO42—、K+、Na+、SO42—
难度: 简单查看答案及解析
-
对于化学反应能否自发进行,下列说法错误的是( )
A.若ΔH﹤0, ΔS﹥0,任何温度下都能自发进行
B.若ΔH﹥0, ΔS﹤0, 任何温度下都不能自发进行
C.若ΔH﹥0 ,ΔS﹥0 ,低温时可自发进行
D.若ΔH﹤0 ,ΔS﹤0 ,低温时可自发进行
难度: 简单查看答案及解析
-
将0.1mol·L-1的醋酸加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸的电离平衡向左移动 D.溶液的c(OH-)增大
难度: 简单查看答案及解析
-
据环保部门测定,我国一些大城市的酸雨pH=3.5。则在下雨(酸雨)时,该地区铁制品腐蚀的正极反应主要是( )
A.Fe -2e-=Fe2+ B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑ D.4OH-- 4e-=2H2O+O2↑
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=0.6 mol·L-1·min-1
难度: 简单查看答案及解析
-
在室温下,0.1 mol·L-1 100ml的氨水中,欲使其溶液的pH减小,又要使氨水电离程度减小,应采取( )
A.通入少量氯化氢气体 B.加入少量水
C.加入少量NaOH固体 D.加入少量NH4Cl固体
难度: 简单查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列各图正确的是( )
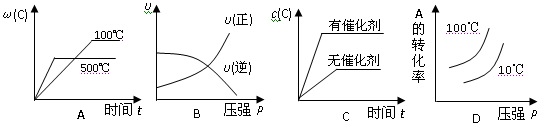
难度: 简单查看答案及解析
-
草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是( )
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
难度: 简单查看答案及解析
-
将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为: ( )
A.40mL 水 B.10mL 0.2 mol·L-1Na2CO3溶液
C.50mL 0.01 mol·L-1 氯化钡溶液 D.100mL 0.01 mol·L-1盐酸
难度: 简单查看答案及解析
-
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为: 2CH3OH + 3O2 + 4OH—
2CO32— + 6H2O, 则下列说法正确的是( )
A.充电时每生成1 mol CH3OH转移6mol电子
B.充电时有CH3OH生成的电极为阳极
C.放电时电解质溶液的pH逐渐增大
D.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O
难度: 简单查看答案及解析
-
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
A.电解时以精铜作阳极
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e-
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
难度: 简单查看答案及解析