-
在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
难度: 中等查看答案及解析
-
航天飞船可用肼(N2H4)作动力源。已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2===N2↑+4H2O。
下列说法中错误的是 ( )
A.该反应中肼作还原剂
B.此情况下,液态肼燃烧生成1molN2时放出的热量为641.6kJ
C.肼(N2H4)分子中只存在极性共价键
D.该反应的反应物总能量高于生成物的总能量
难度: 中等查看答案及解析
-
下列对有关元素的叙述能说明该元素一定是主族元素的是( )
A.原子核外M层有8个电子的元素
B.原子核外L层比M层多一个电子的元素
C.最高价为+7价的元素
D.无负化合价的元素
难度: 中等查看答案及解析
-
如果发现了原子序数为116的元素,对它的不正确叙述是下列组合中的( )
①位于第七周期;②是非金属元素;③最外电子层含有6个电子;
④没有放射性; ⑤属于氧族元素;⑥属于卤素。
A.②④⑥ B.①③⑥ C.①③⑤ D.②③⑤
难度: 中等查看答案及解析
-
某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数( )
A.只有x+1 B.可能是x+8
C.可能是x+2 D.可能是x+1或x+11或x+25
难度: 中等查看答案及解析
-
由下列各组中三种元素构成的化合物中,既有离子晶体又有分子晶体的是( )
A.H、N、O B.Na、S、O C.H、O、C D.H、S、O
难度: 中等查看答案及解析
-
有下列四组物质,每组内物质互为同分异构体的是( )
A.12C和14C B.O2与O3
C.
D.
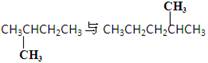
难度: 中等查看答案及解析
-
下列事实可以说明M的非金属性强于N的是( )
A.单质与氢气化合的难易程度:M难于N
B.最高价氧化物对应水化物的酸性:M弱于N
C.简单阴离子的还原性:M强于N
D.M的单质能从含N的简单阴离子的溶液中置换出N单质
难度: 中等查看答案及解析
-
下列有关晶体的说法中正确的是( )
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏
难度: 中等查看答案及解析
-
物质的下列性质能肯定该物质为离子化合物的是 ( )
A.水溶液能导电的化合物 B.由金属元素和非金属元素组成的化合物
C.在熔化状态下能导电的化合物 D.熔点高的物质
难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是 ( )
A.原子半径:Na<Mg<Al B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO4<H2CO3<H2SO4 D.沸点:H2O>H2Se>H2S
难度: 中等查看答案及解析
-
下列各组化合物中化学键类型不同的是( )
A.NaCl和HNO3 B.H2O和 NH3 C.CaF2和 CsCl D.CCl4和H2S
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是( )
A.X、Y元素的金属性 X < Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 困难查看答案及解析
-
共价键,离子键,和分子间作用力是物质间的不同作用力,下述物质中只含上述一中作用力的是( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
难度: 中等查看答案及解析
-
X、Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素阳离子半径;Z和Y两元素的原子最外层电子数相同,Z元素的原子半径大于Y元素的原子半径,X、Y、Z三种元素原子序数的关系是( )
A.X>Y>Z B.Y>X>Z
C.Z>X>Y D.Z>Y>X
难度: 中等查看答案及解析
-
下列有关碱金属铷(Rb)的叙述中,正确的是( )
A.硝酸铷是离子化合物,易溶于水
B.氢氧化铷是弱碱
C.在钠、钾、铷三种单质中,铷的熔点最高
D.铷在氧气中燃烧,产物为Rb2O
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律,判断下列有关描述正确的是( )
A.碱金属元素中,金属活泼性最强的是Li
B.第三周期元素中,原子半径最大的是Cl
C.短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4
D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
难度: 中等查看答案及解析
-
下列关于离子化合物的叙述正确的是( )
A.离子化合物中都含有离子键
B.离子化合物中的阳离子只能是金属离子
C.离子化合物都能溶于水,其水溶液可以导电
D.溶于水可以导电的化合物一定是离子化合物
难度: 中等查看答案及解析
-
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

A.Y、Z的阴离子电子层结构都与R原子的相同
B.常压下,Y单质的沸点比Z单质的沸点低
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强
难度: 困难查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物
C.元素Y、R分别与元素X形成的化合物的热稳定性:
D.元素W、R的最高价氧化物的水化物都是强酸
难度: 困难查看答案及解析
