-
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是( )
A.保持表面干燥 B.表面镀锌
C.表面镶嵌铜块 D.与电源负极相连
难度: 简单查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
A.高铁酸钾与水反应时,水发生氧化反应
B.干法中每生成1mol Na2FeO4共转移4mol电子
C.湿法中每生成1mol Na2FeO4共转移3mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的水溶液中不存在电解质分子
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.不同的弱电解质只要物质的量浓度相同,电离程度也就相同
难度: 简单查看答案及解析
-
下列与有机物的结构、性质有关的叙述正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
难度: 简单查看答案及解析
-
下列化合物中,既能由单质直接化合制得,又能由复分解反应制得的是( )
A.CuS B.FeS C.Al2S3 D.FeCl2
难度: 简单查看答案及解析
-
X、Y、Z和M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y
难度: 中等查看答案及解析
-
常温下,下列叙述正确的是( )
A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水电离出的C(H+)之比为1:1
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7
D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
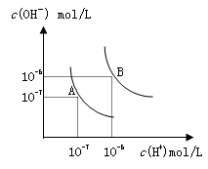
A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某Na2SO4 溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 中等查看答案及解析
-
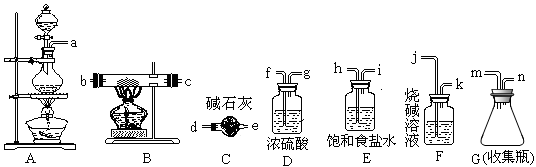
用下列实验装置进行相应实验,能达到实验目的的是( )

A. 实验室用图1所示装置制取少量氨气
B. 用图2 所示装置蒸干AlCl3饱和溶液制备无水AlCl3
C. 用图3装置测量Cu与浓硝酸反应产生气体的体积
D. 用图4所示装置可除去CO2中含有的少量HCl
难度: 简单查看答案及解析
-
航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应)。白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电。下列说法正确的是( )

A.在使用过程中此电池要不断补充水
B.放电时NiOOH在电极上发生氧化反应
C.充电时阴极区电解质溶液pH升高
D.充电时阴极反应为Ni(OH)2-e-+OH-= NiOOH+H2O
难度: 中等查看答案及解析
-
Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s)
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析