-
决定元素种类的是( )
A.质子数
B.电子数
C.中子数
D.最外层电子数难度: 中等查看答案及解析
-
地壳中含量最多的金属元素是( )
A.氧
B.硅
C.铝
D.铁难度: 中等查看答案及解析
-
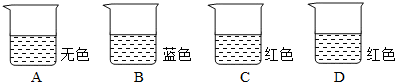
下列数据是一些物质的pH,其中呈碱性的是( )
A.
(8~9)牙膏
B.
(6~7)胡萝卜
C.
(3~4)橘子
D.
(2~3)食醋难度: 中等查看答案及解析
-
下列物质露置于空气中,一段时间后,质量减小的是( )
A.碳酸钙
B.氯化钠
C.浓盐酸
D.氢氧化钠难度: 中等查看答案及解析
-
镁有“国防金属”的美誉.在元素周期表中,镁元素的信息如图所示,对图中信息解释不正确的是( )
A.原子序数为12
B.核外电子数为24
C.元素符号为Mg
D.相对原子质量为24.31难度: 中等查看答案及解析
-
下列方法能鉴别氧气和空气的是( )
A.闻气味
B.将集气瓶倒扣在水中
C.观察颜色
D.将带火星的木条伸入集气瓶中难度: 中等查看答案及解析
-
下列化学方程式书写正确的是( )
A.2P+5O2P2O5
B.Fe2O3+3CO=2Fe+3CO2
C.H2O2H2↑+O2↑
D.NaHCO3+HCl=NaCl+H2O+CO2↑难度: 中等查看答案及解析
-
下列物质的用途中,利用其化学性质的是( )
A.液氮用作冷冻剂
B.干冰用于人工降雨
C.氧气用于气焊
D.浓硫酸用作干燥剂难度: 中等查看答案及解析
-
固体碘受热升华,下列关于此过程的说法正确的是( )
A.碘分子质量变大
B.碘分子间的间隔变大
C.碘分子体积变小
D.碘分子运动速率不变难度: 中等查看答案及解析
-
工业冶炼金属锰的原理是3MnO2+4Al
3Mn+2Al2O3,该反应属于( )
A.置换反应
B.化合反应
C.分解反应
D.复分解反应难度: 中等查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是( )
选项 实验操作 现象 结论 A 向醋酸中加入氢氧化钠溶液 无明显现象 二者之间不发生反应 B 向溶质的质量分数为5%的过氧化氢溶液中加入少量氧化铜 有大量气泡产生 氧化铜起催化作用 C 将两根铁丝分别伸入硫酸铜溶液和硝酸银溶液中 两根铁丝上均有固体附着 金属的活动性顺序为Fe>Cu>Ag D 用导管分别对准浸没在热水和冷水中的白磷通氧气 热水中的白磷燃烧,冷水中的白磷不燃烧 燃烧的条件之一是温度达到着火点
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
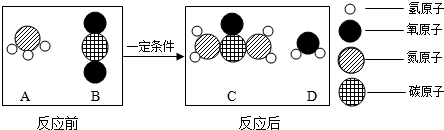
肼(N2H4)是一种无色油状液体,有刺激性气味,有吸湿性.点燃时,迅速而完全燃烧,生成N2和H2O,并放出大量的热.下列关于N2H4的说法不正确的是( )
A.应密封保存
B.完全燃烧的反应属于复分解反应
C.可用作燃料
D.其中氮元素与氢元素的质量比为7:1难度: 中等查看答案及解析
-
下列四个图象中,能正确反映对应变化关系的是( )
A. 向一定量的氢氧化钠溶液中滴加稀盐酸
向一定量的氢氧化钠溶液中滴加稀盐酸
B. 向一定量的稀盐酸中加入大理石
向一定量的稀盐酸中加入大理石
C. 一定量的稀盐酸中加入铁粉
一定量的稀盐酸中加入铁粉
D. 加热一定量的高锰酸钾固体
加热一定量的高锰酸钾固体 难度: 中等查看答案及解析
-
a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃时的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是( )

A.原饱和溶液中,溶质的质量分数a>b=c
B.恢复至t2℃时,析出溶质的质量a>b=c
C.恢复至t2℃时,三种溶液一定都是饱和溶液
D.若继续降温至t1℃,三种溶液一定都是饱和溶液难度: 中等查看答案及解析
-
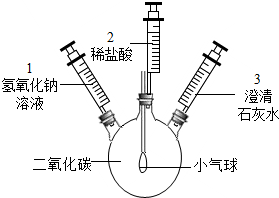
某同学欲测定Na2CO3和NaCl固体混合物中Na2CO3的质量分数,分别取ag样品,按下列方案进行实验,合理的是( )
A.与足量稀盐酸充分反应,用排水法收集到VmL气体
B.与足量稀盐酸充分反应,称量反应后的溶液,质量为m1g
C.与足量Ca(OH)2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m2g固体
D.与足量浓盐酸充分反应,逸出的气体用NaOH固体充分吸收,固体质量增加m3g难度: 中等查看答案及解析
-
下列属于化学变化的是( )
A.冰雪融化
B.纸张燃烧
C.水分蒸发
D.矿石粉碎难度: 中等查看答案及解析
-
下列物质中,属于氧化物的是( )
A.O2
B.SO2
C.HCl
D.NaOH难度: 中等查看答案及解析
-
下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )
A.木炭
B.铁丝
C.蜡烛
D.红磷难度: 中等查看答案及解析
-
下列物质放入水中,能形成溶液的是( )
A.面粉
B.牛奶
C.白糖
D.植物油难度: 中等查看答案及解析
-
下列物品使用的主要材料为有机合成材料的是( )
A. 塑料玩具
塑料玩具
B. 纯棉帽子
纯棉帽子
C. 陶瓷餐具
陶瓷餐具
D.
黄金饰品难度: 中等查看答案及解析
-
碳酸钠可用于制造玻璃,其俗称是( )
A.小苏打
B.熟石灰
C.生石灰
D.纯碱难度: 中等查看答案及解析
-
配制50g溶质的质量分数为6%的氯化钠溶液,不需要的仪器是( )
A.蒸发皿
B.玻璃棒
C.烧杯
D.量筒难度: 中等查看答案及解析
-
下列实验操作中,正确的是( )
A.
滴加液体
B.
稀释浓硫酸
C.
检查气密性
D.
熄灭酒精灯难度: 中等查看答案及解析
-
下列化学符号中,表示2个氢分子的是( )
A.H2
B.2H
C.2H2
D.2H+难度: 中等查看答案及解析
-
下列做法不利于保护环境的是( )
A.垃圾分类处理
B.使用一次性塑料餐盒
C.使用节水龙头
D.乘坐公共交通工具难度: 中等查看答案及解析

 B.馒头
B.馒头 C.牛肉片
C.牛肉片

 铜质奖牌 B.
铜质奖牌 B. 铜导线 C.
铜导线 C. 铜火锅
铜火锅