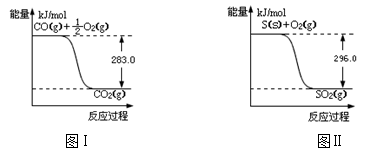
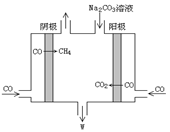
-
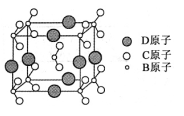
下列有关“化学与生活”的叙述不正确的是
A.凡含有食品添加剂的食物对人体健康均有害
B.使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
C.施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用
D.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
难度: 简单查看答案及解析
-
下列有关原子结构、元素性质的说法正确的是
A.元素原子最外层电子数越多,元素金属性越强
B.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
C.Si、P、S、Cl元素的单质与氢气化合越来越容易
D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小
难度: 中等查看答案及解析
-
在指定溶液中一定能大量共存的离子组是
A.1.0mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42-
B.pH=1的溶液:NH4+、Al3+、SO42-、Br-
C.0.1 mol·L-1FeCl3溶液:NH4+、H+、I-、SCN-
D.常温下,在c(H+)水·c(OH-)水=10—26的溶液中:K+、Fe2+、Cl-、NO3-
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.3.4g H2O2中含有的共用电子对数为0.1NA
B.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA
C.标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0. 1 NA
D.25 ℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA
难度: 困难查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论不一致的是
选项
实验操作
实验目的或结论
A
将Al2(SO4)3、NaOH溶液相互滴加
鉴别Al2(SO4)3、NaOH溶液
B
向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成
说明KSP(AgCl)>KSP(AgI)
C
向NaHS溶液中滴入酚酞,溶液变红色
HS-水解程度大于电离程度
D
向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色
该溶液中一定含有Fe2+
难度: 困难查看答案及解析
-
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是
A. 放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2
B. 放电时,正极区溶液的pH减小
C. 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D. 充电时,电池的锌电极接电源的正极
难度: 困难查看答案及解析
-
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)
3Z(g),平衡时,X、Y、Z的体积分数分别为20%、40%、40%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同,平衡常数值为2
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为1.0 mol·L-1
难度: 困难查看答案及解析