-
下列说法正确的是
A. CO2、NO2或SO2都会导致酸雨的形成 B. 木材浸过水玻璃后,具有良好的防火性能
C. 石英坩埚、水泥、陶瓷都是硅酸盐产品 D. 氯气泄漏后,人应逆风且往低处跑
难度: 简单查看答案及解析
-
下列说法正确的是
A. 钠、氢气都能在氯气中燃烧生成白色烟雾
B. 铜丝在氯气中燃烧,生成蓝绿色的氯化铜
C. 检验Cl2气体中是否混有HCl的方法是将气体通入硝酸银溶液
D. 将CO2通入次氯酸钙溶液可生成具有漂白性的物质
难度: 中等查看答案及解析
-
下列有关浓硫酸与浓硝酸的叙述,不正确的是
A. 露置空气中,两者浓度均降低 B. 常温下,两者均能使铁、铝钝化 C. 一定条件下,两者均能与铜反应 D. 两者都具有强氧化性,均能氧化SO2
难度: 中等查看答案及解析
-
下列有关元素存在及应用的说法正确的是
A. 金属材料都是导体,非金属材料都是绝缘体 B. 工业制硫酸、硝酸的关键步骤都应用了催化氧化的方法
C. 硅胶吸水后不能重复再利用 D. 钠、铝、铁、硫、氯等元素在自然界中只有化合态存在
难度: 中等查看答案及解析
-
浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
A.酸性 B.脱水性 C.强氧化性 D.吸水性
难度: 简单查看答案及解析
-
单质硫有多种同素异形体(如S2 、S4 、S6 、S8等),某种的单质硫分子由x个硫原子组成,取n mol这种硫的单质,在足量的氧气中完全燃烧生成2n molSO2。关于这种单质的结论正确的是
A. 分子式为S8 B. 摩尔质量为64 C. 1mol该单质硫的质量为64g D. 1mol这种单质完全燃烧需44.8L氧气
难度: 中等查看答案及解析
-
在水玻璃中通入足量的CO2气体,充分反应后,加热蒸发,再高温灼烧,则最后所得的固体物质为
A. SiO2与NaHCO3 B. SiO2与Na2CO3 C. SiO2 D. Na2SiO3
难度: 中等查看答案及解析
-
工业上用洗净的废铜作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是
A.

B.

C.

D.

难度: 中等查看答案及解析
-
将0.3 mol Cl2缓缓通入1L含有0.2 mol的H2SO3和0.2 mol的HBr的混合溶液中(忽略溶液体积变化),溶液中H+浓度C(H+)与通入Cl2的物质的量之间的关系图正确的是

难度: 中等查看答案及解析
-
对于反应3S+6KOH
2K2S+K2SO3+3H2O,下列说法正确的是
A. S是氧化剂,KOH是还原剂 B. 若3mol硫完全反应,则反应中共转移了4mol电子 C. 还原剂与氧化剂的质量比是2:1 D. 氧化产物和还原产物的物质的量之比为3:2
难度: 中等查看答案及解析
-
已知某酸性溶液中含有Ba2+、Fe3+,则下列能与上述离子共存的离子组是( )
A. CO32﹣、SO42﹣、NH4+、Na+ B. Cl﹣、SCN﹣、NO3﹣、Cu2+
C. Br﹣、I﹣、Mg2+、Na+ D. H+、Cl﹣、NO3﹣、Al3+
难度: 中等查看答案及解析
-
将等体积的NO2和N2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积约为原总体积的
A.1/6 B.1/3 C.2/3 D.1/2
难度: 中等查看答案及解析
-
下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是
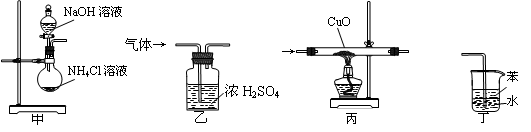
A.用装置甲制取氨气 B.用装置乙除去氨气中的水蒸气
C.用装置丙验证氨气具有还原性 D.用装置丁吸收尾气
难度: 中等查看答案及解析
-
标准状况下,干燥圆底烧瓶中充满NO2和O2的混合气体进行喷泉实验,经充分反应后,瓶内充满水,则瓶内水溶液的物质的量浓度为
A. 5/112 B. 1/28 C. 2/49 D. 8/245
难度: 中等查看答案及解析
-
右图模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是

A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 往漂白粉溶液中通入足量SO2:H2O + SO2 + ClO- = HClO + 2SO3-
B. 往烧碱溶液中通入少量CO2:CO2 + OH- = HCO3-
C. 往水玻璃中加入盐酸:2H+ + SiO32- = H2SiO3↓
D. 向小苏打溶液中加入过量石灰水:2HCO3- + Ca2+ + 2OH- = CaCO3↓ + 2H2O + CO32-
难度: 中等查看答案及解析
-
将一定量的锌放人100mLl8.4mol/L浓硫酸中加热,充分反应后锌完全溶解,同时生成气体X 22.4L(标准状况)。将反应后的溶液稀释至0.8L,测得溶液c(H+)=0.1mol/L,则下列判断错误的是
A. 气体X为SO2和H2的混合物 B. 气体X中SO2与H2的体积相等 C. 反应中共转移2mol电子 D. 反应中共消耗Zn 65 g
难度: 中等查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象
解释
A
用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色
该溶液中一定含有Na+,一定无K+
B
SO2能使酸性高锰酸钾溶液褪色
SO2具有漂白性
C
某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42﹣
D
铁加入稀硝酸中有气泡产生
铁与稀硝酸发生了置换反应
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
某溶液中可能含有I-、NH4+、Cu2+、SO32-,向溶液中加入少量的溴水,反应后溶液呈无色,则下列关于溶液组成的判断正确的是①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
A. ①② B. ①③ C. ②③④ D. ①②③
难度: 中等查看答案及解析
-
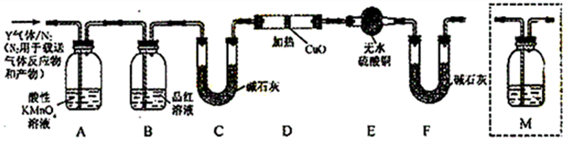
用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是

A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①加水,观察颜色
难度: 困难查看答案及解析