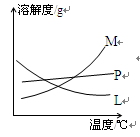
-
(共12分)下图中A~J分别代表代表相关反应的一种物质,已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
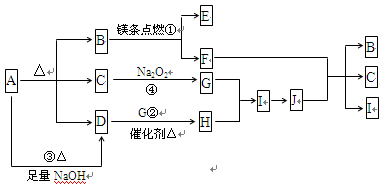
请填写以下空白:
(1)A的化学式________.
(2)写出反应①②的化学方程式:
①________,
②。
(3)写出反应③的离子方程式:________。
(4)J与F反应的化学方程式:________。
(5)在反应④中,当生成标准状况下2.24L G时,转移的电子数为________mol。
难度: 简单查看答案及解析
-
(16分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是:A________,B________,C________,D________。
(2)这四种元素中能形成的气态氢化物的稳定性由大到小的顺序是
________。(用气态氢化物的化学式表示)
(3)A和B形成的三原子分子的化学式是________,B与D形成的既有离子键又含有共价键的化合物的化学式是________。
(4)A元素的某氧化物与D元素的某含氧化合物反应生成单质的化学方程式是________
________。
难度: 简单查看答案及解析