-
运用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率
难度: 简单查看答案及解析
-
在 A+2B
3C+4D 反应中,表示该反应速率最快的是 ( )
A.v(A)=0.3 mol/(L·s) B.v
(B)=0.5 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·min)
难度: 简单查看答案及解析
-
已知 298K 时,H+(aq)+ OH-(aq)= H2O(l) △H = -57.3 kJ/ mol ,推测含 1molCH3COOH 的稀溶液与含 1 mol NaOH 的稀溶液反应放出的热量( )
A.大于 57.3 kJ B.等于 57.3 kJ C.小于 57.3
kJ D.无法确定
难度: 中等查看答案及解析
-
下列各对物
质中,互为同系物的是( )

难度: 中等查看答案及解析
-
用 NA 表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.22.4LCO2 与足量的 Na2O2 反应时,转移的电子数为 NA 个
B.0.1mol 铁在 0.1molCl2 中充分燃烧,转移的电子数为 0.2NA
个
C.对于反应:A(g)+B(g)
C(g)+D(g)单位时间内生成 NA 个 A 分子时,同
时消耗NA 个 C 分子,说明该反应一定达到最大限度
D.Zn -H2SO4-Cu 原电池中,当电路中有 NA 个电子通过时,溶液的质量增加 1g
难度: 简单查看答案及解析
-
已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O
C H3COO-+H3O+
K1=1.75×10-5 mol·L-1
CH3COO-+H2O
CH3COOH+OH-
K2=5.71×10-10 mol·L-1
现将 50 mL 0.2 mol·L-1 醋酸与 50 mL 0.2 mol·L-1 醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2 同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.
若在溶液甲中加入 5 mL 0.1 mol·L-1 的盐酸,则溶液中醋酸的 K1 会变大
难度: 中等查看答案及解析
-
下列各组实验中溶液最先变浑浊的是( )
A.0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度10℃
B.0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 10℃
C.0.1mol/L Na2S2O3 和H2SO4各 5mL,加水 5mL,反应温度 30℃
D.0.2mol/L Na2S2O3 和H2SO4 各 5mL,加水 10mL,反应温度 30℃
难度: 简单查看答案及解析
-
已知热化学方程式:2SO2(g)+O2(g)
2SO3(g); H=-Q k
J·mol-1(Q>0)。下列说法 正确的是( )
A.相同条件下,2 mol SO2(g)和 1 mol O2(g)所具有的能量小于 2 mol SO3(g)所具有的能量
B.将 2 mol SO2(g)和 1 mol O2(g)置于一密闭容器中充分反应后,放出热量为 Q kJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量 SO2(g)和 O2(g)置于某密闭容器中充分反应放热 Q kJ,则此过程中有 2 mol SO2(g)被氧化
难度: 简单查看答案及解析
-
在一密闭容器中进行如下反应:3H2(气)+N2(气)
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3 的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.H2 为 0.6mol/L、N2 为 0.
2mol/L B.NH3 为 0.25mol/L
C.N2、NH3 均为 0.15mol/L D.NH3 为 0.4mol/L
难度: 中等查看答案及解析
-
常温下下列各组离子在指定溶液中能大量共存的是( )
A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+
B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+
C.c(H+)/c(OH-)=1×1012 的溶液中:NH+4、Cl-、NO-3、Al3+
D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN-
难度: 困难查看答案及解析
-
已知某可逆反应 mA(g)+ nB(g)
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )
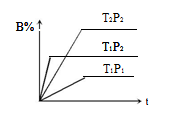
A、T1<T2、P1>P2、m+n>p,△H <0;
B、T1>T2、P1<P2、m+n>p,△H >0;
C、T1>T2、P1<P2、m+n<p,△H >0;
D、T1<T2、P1>P2、m+n<p,△H <0;
难度: 困难查看答案及解析
-
右图装置中,U 型 管内为红墨水,a、b 试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是( )

A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e- === Fe2+
D.a 试管中发生了吸氧腐蚀,b 试管中发生了析氢腐蚀
难度: 困难查看答案及解析
-
已知常温下,KSP(AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17mol2·L-2,下列叙述中, 正确的是( )
A.常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小
B.向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色
C.将 0.001 mol·L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀
D.向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-)
难度: 中等查看答案及解析
-
如图所示,甲池的总反应式为 2CH3OH
+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是( )
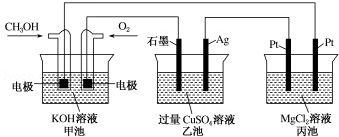
A.若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银
B.甲池通入 CH3OH 的电极反应式为 CH3OH+6e﹣+2H2O═CO2-3+8H+
C.反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4 溶液恢复到 原浓度
D.甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体
难度: 中等查看答案及解析
-
将 0.1 L 含有 0.02mol CuSO4 和 0.01molNaCl 的水溶液用惰性电极电解。电解一段时间后,一个电极上得到 0.01 mol Cu,另一电极析出的气体( )
A.只有 Cl2 B.既有 Cl2 又有 O2 C.只有 O2 D.只有 H2
难度: 简单查看答案及解析
-
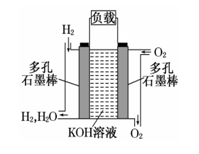
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列关于该电池的叙述错误的是( )
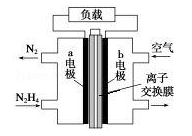
A、b极发生还原反应
B、a极的反应式为N2H4 - 4e-===N2↑+4H+
C、放电时,电流从b极经过负载流向a极
D、其中的离子交换膜需选用阴离子交换膜
难度: 中等查看答案及解析