-
已知Cu+在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平).NH4CuSO3与足量的10mol•L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色.据此判断下列说法一定合理的是( )
A.该反应显示硫酸具有酸性
B.NH4CuS03中铜元素全部被氧化
C.刺激性气味的气体是氨气
D.反应中硫酸作氧化剂难度: 中等查看答案及解析
-
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的混合气体体积为(设反应中HNO3被还原成NO)( )
A.0.448L
B.0.672
C.0.896
D.0.224难度: 中等查看答案及解析
-
十八大报告中提到要加快生态文明建设的步伐,下列措施有利于生态文明建设的是( )
①研发易降解的生物农药 ②开发生产无汞电池 ③田间焚烧秸秆 ④应用高效洁净的能源转换技术 ⑤加快化石燃料的开采与使用.
A.①③⑤
B.①②④
C.②③⑤
D.②④⑤难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.用丁达尔现象可以区分乙醇溶液和淀粉溶液
B.16O转化为18O属于化学变化
C.实验室中,钠通常保存在盛有煤油的细口瓶中
D.定容时仰视容量瓶刻度线,所配制的NaOH溶液浓度将偏高难度: 中等查看答案及解析
-
分类法是学习和研究化学的一种常用的科学方法,下列分类合理的是( )
①根据分散质粒子的大小将分散系分为溶液、胶体和浊液
②根据原子最外层电子数的多少将元素分为金属元素和非金属元素
③根据是否有新物质生成将物质变化分为物理变化和化学变化.
A.①②③
B.②③
C.①②
D.①③难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.明矾可以净水:Al3++3H2O═Al(OH)3↓+3H+
B.少量小苏打溶液滴入Ba(OH)2溶液中:HCO-3+Ba2++OH-═BaCO3↓+H2O
C.氧化钠与水反应:O2-+H2O═2OH-
D.氧化亚铁加入稀硝酸:FeO+2H+═Fe2++H2O难度: 中等查看答案及解析
-
以下表述不符合元素周期律观点的是( )
A.酸性:H3PO4>HNO3>HClO4
B.稳定性:HF>H2O>NH3
C.微粒半径:F->Na+>Mg2+
D.还原性:HI>HBr>HCl难度: 中等查看答案及解析
-
下列物质与其用途完全符合的有( )
①Na2CO3-制玻璃 ②SiO2-太阳能电池 ③AgI-人工降雨 ④NaCl-制纯碱⑤Al2O3-焊接钢轨 ⑥NaClO-消毒剂 ⑦Fe2O3-红色油漆或涂料 ⑧MgO-耐火材料.
A.4条
B.5条
C.6条
D.7条难度: 中等查看答案及解析
-
实验室欲配制一种仅含四种离子(不考虑来源于水电离的离子)的溶液,且溶液中四种离子的浓度均为1mol•L-1.能达到此目的是( )
A.Al3+、Cu2+、SO42-、Cl-
B.Mg2+、K+、SO42-、NO3-
C.ClO-、I-、K+、Na+
D.Mg2+、HCO3-、SO42-、OH-难度: 中等查看答案及解析
-
下列说法正确的是( )
A.等体积、等密度的CO和C2H4所含原子数相等
B.Na218O2与水反应生成氧气的相对分子质量为34
C.OD-中所含电子数和中子数相等
D.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等难度: 中等查看答案及解析
-
如图表示某一反应过程中的能量变化曲线.下列说法中不正确的是( )
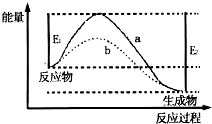
A.该反应为放热反应
B.该反应的焓变为△H=-(E2-E1)
C.曲线b相对曲线a来说,改变的条件是使用了催化剂
D.该反应发生的条件一定是加热难度: 中等查看答案及解析
-
下列有关平衡常数的说法正确的是( )
A.已知K=,则对应的化学反应可以表示为:2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)
B.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
C.常温下,向纯水中加入碳酸钠固体,水的电离程度变大,Kw变大
D.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
①C、CO ②AlCl3、Al(OH)3 ③N2、NO ④S、SO2.
A.①②
B.②③
C.③④
D.①④难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.5molO3与11.2LO2所含的分子数一定相等
B.在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得到NH3分子数为NA
C.常温常压下,7.0g乙烯与丁烯的混合物中含有氢原子的数目为NA
D.标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子数为3NA难度: 中等查看答案及解析
-
反应2NO2(g)⇌N2O4(g)△H<0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )

A.a、c两点的反应速率:a>c
B.a、c两点NO2的转化率:a>c
C.b、c两点的化学平衡常数:b=c
D.由状态b到状态a,可以用加热的方法难度: 中等查看答案及解析
-
在密闭容器中发生反应:aX(g)+bY(g)⇌cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述中不正确的是( )
A.Z的体积分数增大
B.a+b<c+d
C.平衡向逆反应方向移动
D.X的转化率下降难度: 中等查看答案及解析
-
将0.1mol•L-1的氨水加水稀释至0.01mol•L-1,稀释过程中温度不变.下列叙述正确的是( )
A.稀释后溶液中c(H+)和c(OH-)均减小
B.稀释后溶液中c(OH-)变为稀释前的
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中增大
难度: 中等查看答案及解析
-
某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色难度: 中等查看答案及解析


