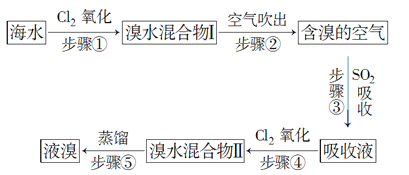
-
只含C、H、O三种元素的化合物完全燃烧后生成CO2和H2O。某物质的分子组成CxHyOz,取该物质m g在足量的O2中完全燃烧,将产物全部通过足量的Na2O2,充分反应后,Na2O2的质量增加m g,则该物的分子组成必定满足
A. x=y B. x=y=z C. y=z D. x=z
难度: 困难查看答案及解析
-
进行化学实验和探究时应注意安全,可以从试剂的存放、使用及实验操作、废弃物的处理等方面采取安全措施。下列说法合理的是
①生石灰可以与浓盐酸放在同一个药品柜中;②取用化学试剂时不能用手直接去取;
③不能直接用鼻子闻二氧化硫气体的气味;④用酒精灯加热烧杯要加垫石棉网;
⑤用酒精灯加热盛在烧瓶里的液体要加碎瓷片或沸石;
⑥在烧杯中稀释浓硫酸时,要使水沿着烧杯内壁慢慢流入浓硫酸中;
⑦用排水法收集加热氯酸钾生成的氧气,后期的操作是先停止加热,然后将导气管从水中取出,再取起集气瓶;
⑧点燃氢气前要验纯,点燃甲烷气体前不需要验纯
⑨废H2SO4溶液可用石灰水中和至溶液呈中性。
A. ①②③④⑤⑧ B. ①②③④⑤⑨ C. ②③④⑤⑨ D. ②③④⑤⑥⑦
难度: 中等查看答案及解析
-
下列叙述正确的是:
A. 一定温度、压强下,气体体积由其分子的大小决定
B. 一定温度、压强下,气体体积由其物质的量的多少决定
C. 气体摩尔体积是指1mol任何气体所占的体积为22.4L
D. 不同的气体,若体积不等,则它们所含的分子数一定不等
难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起了非常重要的作用。下列分类标准合理的是( )
①根据酸分子中含氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A. ①③ B. ②④ C. ①②④ D. ②③④
难度: 中等查看答案及解析
-
下列物质中,属于电解质的是( )
①汞②浓氨水③氯化钠晶体④硝酸⑤干冰⑥蔗糖⑦硫酸
A. ①③④ B. ③④⑦ C. ②③④ D. ⑤⑥
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 硫酸氢钠溶液与小苏打溶液的反应:H+ + HCO3- = CO2↑ + H2O
B. 用苛性钠溶液吸收过量SO2:SO2 +2OH-= SO32- + H2O
C. 二氧化锰和浓盐酸反应:MnO2+4HCl
Mn2++2Cl2↑+2H2O
D. 工业上氯气和石灰乳反应制漂白粉:Cl2 + 2OH-= ClO-+ Cl- + H2O
难度: 中等查看答案及解析
-
在pH=1的无色溶液中,下列离子能大量共存的是
A. NH4+、Ba2+、NO3-、CO32-
B. Fe2+、OH-、SO42-、MnO4-
C. K+、Mg2+、NO3-、SO42-
D. Na+、Fe3+、Cl-、AlO2-
难度: 简单查看答案及解析
-
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+; Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,则:( )
A. 还原性Cr3+>Fe2+>SO2 B. 氧化性Cr2O72->SO2>Fe3+
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 两个反应中Fe2(SO4)3均作还原剂
难度: 中等查看答案及解析
-
有一镁铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量与加入氢氧化钠的体积关系如图所示,原合金中镁铝的质量比为
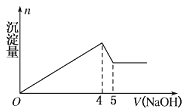
A. 4:9 B. 4:3 C. 8:9 D. 20:27
难度: 中等查看答案及解析
-
Fe和Fe2O3混合物共27.2g,加入200mL稀H2SO4,收集到标准状况下2.24LH2, 所得溶液中滴加KSCN溶液,不变色。为中和过量的H2SO4,并使溶液中的金属阳离子全部转化为沉淀,共消耗了4 mol/L 的NaOH溶液300 mL,则该H2SO4的物质的量浓度为( )
A. 0.5mol/L B. 2mol/L C. 2.25mol/L D. 3mol/L
难度: 困难查看答案及解析
-
下列关于硅的说法正确的是
①硅在自然界中以游离态和化合态两种形式存在 ②水泥是硅酸盐材料
③单质硅是良好的半导体 ④氮化硅陶瓷是新型的无机非金属材料
⑤水玻璃可以用作木材防火剂 ⑥光导纤维属于硅酸盐产品
A. ①③④⑥ B. ②③④⑤ C. ①②⑤⑥ D. ②③④⑥
难度: 中等查看答案及解析
-
实验室用MnO2和浓盐酸反应制Cl2,若有0.4mol HCl被氧化,将所得气体全部用消石灰吸收,理论上可得漂白粉的质量为
A. 50.6g B. 28.6g C. 25.4g D. 14.3g
难度: 简单查看答案及解析
-
下列说法正确的是
①除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
②二氧化硅不与任何酸反应,可用石英制造耐酸容器
③二氧化氯具有还原性,可用于自来水的杀菌消毒
④CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
⑤向装有Fe(NO3)2溶液的试管中加入稀H2SO4管口观察到红棕色气体,结论: HNO3分解成了NO2
⑥A1箔表面被HNO3氧化,形成致密的氧化膜,将Al箔插入稀HNO3无明显现象
⑦液溴易挥发,在存放液溴的试剂瓶中应加水封
A. ①③ B. ④⑦ C. ②③⑥ D. ①⑦
难度: 困难查看答案及解析
-
有关氨气的实验较多,对这些实验的实验原理的分析中,正确的是
A. 氨气极易液化的性质可以解释氨气的喷泉实验
B. 氨气的还原性可以解释氨气与氯化氢的反应实验
C. 铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
D. NH3•H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气
难度: 中等查看答案及解析
-
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为
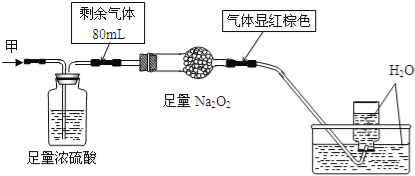
A. NH3、NO2、N2 B. NH3、NO、CO2 C. NH3、NO2、CO2 D. NO、CO2、N2
难度: 困难查看答案及解析
-
1 L含有HNO3、Fe(NO3)3、Cu(NO3)2三种溶质的溶液,三者的物质的量浓度之比为4∶1∶1,慢慢向其中加入铁粉,以下图象正确的是(横坐标表示加入Fe的物质的量,单位:mol;纵坐标表示Fe2+的物质的量浓度,单位:mol·L−1)
A.
 B.
B. 
C.
 D.
D. 
难度: 困难查看答案及解析
-
在100 ml 混合酸中,HNO3和H2SO4的物质的量浓度分别为0.4 mol/L 和0.1 mol/L ,向该混合液中加1.92 g 铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是
A. 0.15 mol/L B. 0.225 mol/L
C. 0.35 mol/L D. 0.45 mol/L
难度: 困难查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A. 60 mL B. 45 mL C. 30 mL D. 15 mL
难度: 中等查看答案及解析
-
下列反应中,浓硫酸既表现强氧化性,又表现酸性的是
①2NaC1(固)+ H2SO4(浓)
Na2SO4+2HC1↑
②C +2H2SO4(浓)
CO2↑+ 2SO2↑+2H2O
③Cu+2H2SO4(浓)
CuSO4+ SO2↑+2H2O
④2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
A. ①② B. ③④ C. ①③ D. ②④
难度: 中等查看答案及解析
-
下列关于元素周期表的描述正确的是( )
A. 有7个周期,18个族
B. 第IA族元素也称为碱金属元素
C. 元素种类最多的族为第IIIB族
D. 第七周期若排满,最多可排50种元素
难度: 简单查看答案及解析
-
关于
F-微粒叙述正确的是
A. 质量数为19,电子数为9 B. 质子数为9,中子数为10
C. 质子数为9,电子数为9 D. 中子数为10,电子数为8
难度: 中等查看答案及解析
-
下列关于碱金属元素和卤素的说法中错误的是( )
A. 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B. 碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强
C. 溴单质与水的反应比氯单质与水的反应更剧烈
D. 钾与水的反应比钠与水的反应更剧烈
难度: 中等查看答案及解析
-
R、X、Y、Z、W是短周期主族元素,它们在元素周期表中的相对位置如图所示。R最高价氧化物对应水化物与其简单气态氢化物反应可以形成离子化合物。下列推断正确的是
R
X
Y
Z
W
A. 最简单气态氢化物的热稳定性由强到弱的排序: Z 、R 、X 、Y
B. R、X、Y、Z、W各元素最高价和最低价的绝对值之和均为8
C. 最高价氧化物的水化物酸性由弱到强的排Z、R、W
D. RY3、W2X、ZW5分子中每个原子最外层都达到8 电子结构
难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是

①Na、Na2O、Na2O2 ②A1Cl3、A1(OH)3、NaA1O2
③)Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3
A. ①②④ B. ②④ C. ①②③ D. ①②③④
难度: 中等查看答案及解析
-
将一定质量的Mg和Al的混合物投入200 ml稀盐酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )

A. Mg和Al的总质量为9g
B. 盐酸的物质的量浓度为5 mol/L
C. NaOH溶液的物质的量浓度为5 mol/L
D. 生成的H2在标准状况下的体积为11.2 L
难度: 困难查看答案及解析