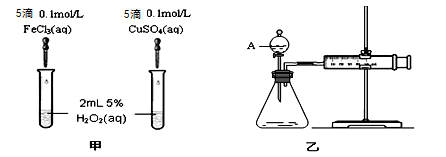
-
下列电离方程式正确的是( )
A.H2S
2H++S2-
B.HF=H++F-
C.NaHCO3=Na++H++CO32-
D.H2CO3+H2O
H3O++HCO3-
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.非自发反应在任何条件下都不能实现
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.凡是放热反应都是自发的,吸热反应都是非自发的
D.熵增加且放热的反应一定是自发反应
难度: 简单查看答案及解析
-
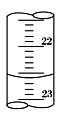
有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10mL刻度处,现把管内液体全部流下排出,用量筒接收,所得溶液的体积( )
A. 不能确定 B. 为40mL C. 为10mL D. 大于为40mL
难度: 简单查看答案及解析
-
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为 H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2
C.ΔH1=ΔH3>ΔH2
D.ΔH1>ΔH3>ΔH2
难度: 中等查看答案及解析
-
如下图所示,ΔH1=-393.5 kJ•mol-1,ΔH2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )

A.C(s,石墨)= C(s,金刚石) ΔH= +1.9 kJ•mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 中等查看答案及解析
-
已知500℃时,反应H2(g)+I2(g)
2HI(g)的K=100,由此推测在500℃时,反应HI(g)
1/2H2(g)+1/2I2(g)的化学平衡常数为( )
A.0.01 B.100 C.0.1 D.无法确定
难度: 简单查看答案及解析
-
对于反应A(g)+3B(g)
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A.v(A)=0.01 mol/(L•s) B.v(C)=1.0mol/(L•min)
C.v(B)=0.60mol/(L•min) D.v(B)=0.04 mol/(L•s)
难度: 简单查看答案及解析
-
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)
H2(g)+I2(g)。若c(HI)由1.0 mol/L降低到0.7 mol/L时,需要15 s,那么c(HI)由0.7 mol/L降到 0.5 mol/L时,所需反应的时间为( )
A.等于5 s B.等于10 s C.大于10 s D.小于10 s
难度: 中等查看答案及解析
-
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列正确的是( )
甲.在500℃时,SO2和O2各10 mol反应
乙.在500℃时,用V2O5作催化剂,10 mol SO2和10 mol O2反应
丙.在450℃时,8 mol SO2和5
mol O2反应
丁.在500℃时,8 mol SO2和5 mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
难度: 中等查看答案及解析
-
现
有0.1 mol·L-1醋酸溶液10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是
①电离程度增大 ②c(CH3COOH)增大 ③CH3COO-数目增多 ④c(H+)增大
⑤导电性增强 ⑥
增大 ⑦c(OH-)增大
A.①②③⑦ B.①③⑤⑥ C.①③⑥⑦ D.②④⑤⑥
难度: 中等查看答案及解析
-
某温度下,在固定容积的密闭容器中,可逆反应A(气)+3B(气)
2C(气)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C ,则下列说法正确的是( )
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,B的体积分数减小
D.再达平衡时,正反应速率增大,逆反应速率减小
难度: 中等查看答案及解析
-
密闭容器发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.5倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a<c+d
难度: 中等查看答案及解析
-
已知某可逆反应mA(g)+nB(g)
qC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中正确的是( )
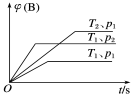
A.p1<p2,T1>T2,m+n<q,ΔH>0
B.p1>p2,T1<T2,m+n>q,ΔH<0
C.p1<p2,T1>T2,m+n>q,ΔH>0
D.p1>p2,T1<T2,m+n<q,ΔH<0
难度: 中等查看答案及解析
-
已知反应:2A(g)
2B(g)+D(?) ;△H<0 。在一定温度下,将1molA充入恒容密闭容器中充分反应达平衡,改变下列条件,以下说法正确的是 ( )
A.降低温度,当A质量不变时,说明该反应达平衡
B.若D为气体,再加入1mol A,平衡正向移动,A的转化率增大
C.升高温度,正反应的平衡常数增大
D.若D为固体,再加入1mol A,平衡不移动,A在混合气体中的百分含量不变
难度: 中等查看答案及解析
-
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
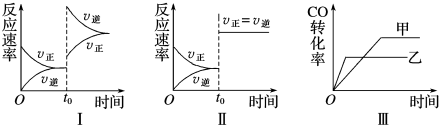
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.H2O2的溶液中:Na+,F-,SO32-;
B.c(OH-)/c(H+)=1012的溶液中:Fe2+、NO3-、SO42-、Na+;
C.由水电离的c(H+)=1×10-14mol·L-1的溶液中:K+、Ba2+、Cl-、NO3-;
D.pH=1的溶液中:Na+,K+,Cl-,S2O32-;
难度: 中等查看答案及解析
-
用0.01mol·L-1 H2SO4滴定0.01mol·L-1NaOH溶液,中和后加水至100mL。若滴定时终点判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05mL)。则②和①的pH之差值为
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)
2C(g) ΔH<0,若起始温度相同,分别向三个容积相同的容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
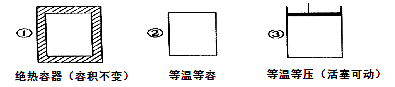
A.③②① B.③①② C.①②③ D.②①③
难度: 中等查看答案及解析
-
下列有关化学平衡移动叙述中正确的是( )
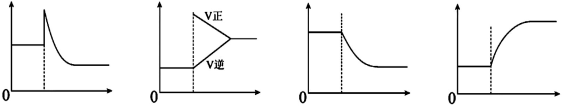
图一 图二 图三 图四
A.可逆反应:Cr2O72-(橙色)+H2O
2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一
B.可逆反应Co(H2O)62+(粉红色)+4Cl-
CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二
C.可逆反应:2NO2
N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如上图三
D.可逆反应:N2(g)+3H2(g)
2NH3(g) △H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四
难度: 困难查看答案及解析
-
已知:CO(g)+H2O(g)
CO2(g)+H2(g)△H=﹣41kJ/mol,相同温度下,在体积相同的三个密闭容器中,加入一定量的物质发生反应,相关数据如下:
容器编号
起始时各物质物质的量/mol
平衡时反应中的能量变化
CO
H2O
CO2
H2
Ar[
①
1
4
0
0
0
放出热量:32.8 kJ
②
0
3
1
1
0
热量变化:Q1
③
0.5
3.5
0.5
0.5
1
热量变化:Q2
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.热量数值:Q2 < Q1 =32.8 kJ
C.平衡时,三容器中CO2的浓度相等
D.容器③中反应开始时正反应的浓度商小于该反应平衡常数K
难度: 困难查看答案及解析