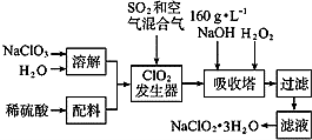
-
化学与环境、材料、信息、生活关系密切,下列说法正确的是( )
A.“山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关
B.硫、氮、碳的氧化物是形成酸雨的主要物质
C.计算机芯片的主要成分是二氧化硅
D.自来水厂常用明矾作消毒杀菌剂
难度: 简单查看答案及解析
-
下列表达正确的是( )
A.丙烷的球棍模型:
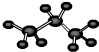
B.CO2的比例模型:

C.硫离子结构示意图:
D.次氯酸的结构式:H—Cl—O
难度: 简单查看答案及解析
-
在指定溶液中一定能大量共存的离子组是( )
A.1.0mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42-
B.pH=1的溶液:NH4+、Al3+、SO42-、Br-
C.c(ClO-)=1.0mol·L-1的溶液:Na+、SO32-、S2-、Cl-
D.与铝反应产生H2的溶液中:Na+、Mg2+、HCO3-、SO42-
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.16g CH4所含原子数目为NA
B.1mol·L-1 NaCl溶液含有NA个Na+
C.常温常压下,22.4L CO2中含有NA个CO2分子
D.2.4g Mg与足量盐酸反应转移的电子数为0.2NA
难度: 简单查看答案及解析
-
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
A.F、Cl、Br、I非金属性依次减弱;HF、HCl、HBr、HI的酸性也依次减弱
B.通入CO2可增强漂白粉溶液漂白性;通入SO2也可增强漂白粉溶液漂白性(不考虑SO2溶解)
C.Al(OH)3、Cu(OH)2受热易分解;Fe(OH)3受热也易分解
D.Na在空气中燃烧会生成Na2O2;Li在空气中燃烧也会生成Li2O2
难度: 简单查看答案及解析
-
某烯烃分子式为C6H12,其同分异构体中主链为4个碳原子的有 ( )
A.2种 B.3种 C.4种 D.5种
难度: 简单查看答案及解析
-
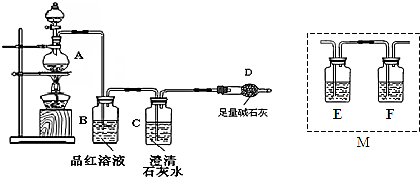
从海带中提取碘的实验过程中,下列操作正确的是( )
A.
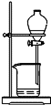 放出碘的苯溶液
放出碘的苯溶液B.
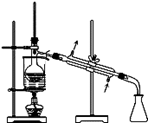 分离碘并回收苯
分离碘并回收苯C.
将海带灼烧
D.
过滤含I-溶液
难度: 中等查看答案及解析
-
下表所示W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是 ( )
X
Y
W
Z
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.X的阴离子比Y的阴离子离子半径大
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.氢氧化铜溶液与硫酸溶液的反应:Cu(OH)2+2H+=Cu2++2H2O
C.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
D.硫酸铜溶液和氢氧化钡溶液:SO42-+Ba2+=BaSO4↓
难度: 简单查看答案及解析
-
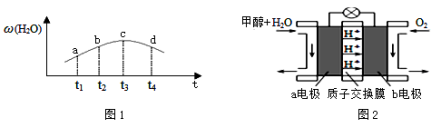
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3﹣Na2O,O2﹣可以在其中自由移动.
下列有关叙述正确的是( )

A. 电极a的反应式为:CH4+4O2﹣﹣8e﹣=CO2+2H2O
B. 电极b是正极,O2﹣由电极a流向电极b
C. 瓦斯分析仪工作时,电池内电路中电子由电极 a流向电极b
D. 当固体电解质中有2 mol O2﹣通过时,外电路通过电子8 mol
难度: 简单查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是( )
A.pH=7的氨水与氯化铵的混合溶液中:[Cl-]>[NH4+]
B.25℃时pH=2的一元酸和pH=12的一元强碱等体积混合:[OH-]=[H+]
C.0.1mol·L-1的硫酸铵溶液中:[NH4+]>[SO42-]>[H+]
D.0.1mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]
难度: 简单查看答案及解析
-
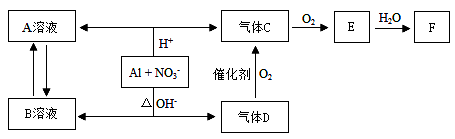
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如右图所示的关系。下列说法正确的是( )
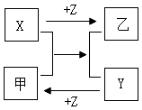
A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.如果X、Y都为非金属单质,则Z必为金属单质
D.如果X、Y都为金属单质,则Z必为非金属单质
难度: 困难查看答案及解析
-
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s) + 4CO(g)
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
下列说法正确的是( )
温度/℃
25
80
230
平衡常数
5×104
2
1.9×10-5
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g)
Ni(s) + 4CO(g)的平衡常数为0.5
C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol·L-1,则此时温度高于80℃
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小
难度: 简单查看答案及解析
-
某温度下,向一定体积0.1 mol·L-1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示。
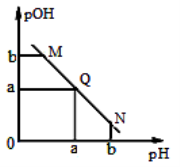
下列说法正确的是( )
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
难度: 简单查看答案及解析