-
下列反应属于吸热反应的是
①二氧化碳与赤热的炭反应生成一氧化碳
②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2
④Ba(OH)2·8H2O固体与NH4Cl固体反应
⑤植物通过光合作用将CO2转化为葡萄糖
A.②④ B.①⑤ C.①③④⑤ D.①④⑤
难度: 简单查看答案及解析
-
如图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示中,正确的是
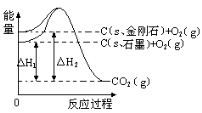
A.金刚石比石墨稳定性好
B.石墨和金刚石的转化是物理变化
C.C(s、石墨)= C(s、金刚石) △H= +1.9 kJ•mol-1
D.断裂1 mol石墨中的化学键吸收的能量比断裂1 mol金刚石中的化学键吸收的能量小1.9 kJ
难度: 中等查看答案及解析
-
下列叙述正确的有
①化学键只存在分子之内
②离子化合物中不可能含非极性键
③共价化合物中不可能含离子键
④由非金属元素形成的化合物都是共价化合物
⑤强电解质一定是离子化合物
⑥共价化合物可以是非电解质
⑦稳定性:H2O> H2S,跟氢键有关
A.2个 B.3个 C.4个 D.5个
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.向FeI2的溶液中,通入足量Cl2:2Fe2++2I-+2Cl2=I2+2Fe3++4Cl-
B. Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+=Fe3+ + 3H2O
C.向水玻璃中通入过量的CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
D. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
难度: 困难查看答案及解析
-
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.H+(aq) +1/2SO42— (aq)+1/2Ba2+(aq)+OH
(aq)=1/2BaSO4(s)+H
O(1);△H=
57.3 kJ/mol
B.KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l);△H=
57.3kJ/mol
C.C8H18(l)+ 25/2O2(g)=8CO2 (g)+ 9H2O(g); △H=
5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2 (g)+18H2O(1); △H=
5518 kJ/mol
难度: 中等查看答案及解析
-
国际无机化学命名委员会在1989年做出决定,把元素周期表原先的主、副族及族号取消,由左至右改为18列。如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法错误的是
A.只有第2列元素的原子最外层有2个电子
B.第3列元素种类最多
C.第15列元素的最高价氧化物为R2O5
D.第17列元素的第一种元素无含氧酸
难度: 中等查看答案及解析
-
最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种氢粒子是由3个氢原子核(只含质子)和2个电子构成的。对于这种粒子,下列说法中正确的是
A.是氢的一种新的同素异形体
B.3g该新型氢粒子含电子2NA
C.是氢的一种新的同位素
D.它的组成可用H3表示
难度: 简单查看答案及解析
-
下列说法正确的是
A.IA族元素的金属性比IIA族元素的金属性强
B.第三周期元素的离子半径从左到右逐渐减小
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增加
D.VIA族元素的氢化物中,稳定性最好的其沸点也最高
难度: 中等查看答案及解析
-
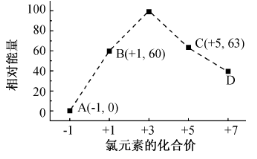
自然界中氯化钠是由2311Na与3517Cl和3717Cl所构成的.已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含3717Cl的质量为
A.1.5g B.1.65g C.1.75g D.1.85g
难度: 中等查看答案及解析
-
某元素最高价氧化物对应水化物的化学式为HnRO2n-2,这种元素的气态氢化物中R元素的化合价为
A.2n-4 B.2n-6 C.2n-10 D.3n-12
难度: 中等查看答案及解析
-
下表是部分短周期元素原子半径及主要化合价,根据表中信息,判断以下叙述不正确的是
元素代号
K
L
M
Q
R
T
N
原子半径/nm
0.183
0.160
0.143
0.102
0.089
0.074
0.152
主要化合价
+1
+2
+3
+6、-2
+2
-2
+1
A.K、L、M三种元素的金属性逐渐减弱
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为非电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
难度: 中等查看答案及解析
-
由两种短周期元素组成的化合物XY3,若两种元素的原子序数分别为a和b,则a和b的关系正确的是
①a=b+4;②a+b=8;③a+b=30;④a=b+8
A.1个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为
A.+130 B.-118 C.+350 D.-332
难度: 中等查看答案及解析
-
铊(Tl)是某超导材料的组成元素之一,与铝同主族,位于第六周期。Tl3+与Ag在酸性介质中发生反应Tl3++2Ag=Tl++2Ag+。下列推断正确的是
A.Tl+的最外层有一个电子 B.Tl3+的氧化性比Al3+弱
C.Tl能形成+3价和+1价的化合物 D.Tl+的还原性比Ag强
难度: 中等查看答案及解析
-
X和Y均为短周期元素,已知aXn-比bYm+多2个电子层,则下列说法正确的是
A.X只能位于第三周期 B.b<5
C.a+n-b+m=16 D.Y不可能位于第2周期
难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
难度: 中等查看答案及解析
-
三种短周期元素A、B、C的原子序数依次增大,A3-与B2-、C+的电子层结构相同。下列说法中不正确的是
A.三种元素可组成CAB2和CAB3型化合物
B.离子半径:A3-> B2-> C+
C.氢化物稳定性:AH3>H2B
D.B的某种单质可用于杀菌消毒
难度: 中等查看答案及解析
-
X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的最外层电子数是次外层的两倍,也是X、W最外层电子数之和的两倍,Z是地壳中含量最多的元素,R的单核离子在同周期元素形成的单核离子中半径最小。以下说法中正确的是
A.R形成的盐一定不能与Y的最高价氧化物对应的水化物发生反应
B.Z、W形成的化合物中只有一种类型的化学键
C.Y、Z的氢化物的稳定性Y<Z
D.X的原子半径一定小于Z
难度: 中等查看答案及解析
-
在100mL含等物质的量HBr和H2SO3的溶液里通入标准状况224mlCl2,有一半Br-变为Br2。则反应后溶液中SO42-的浓度等于(假设反应前后溶液体积忽略不计)
A.0.08mol/L B.0.0018mol/L C.0.075mol/L D.0.0075mol/L
难度: 困难查看答案及解析