-
2011年是国际化学年,主题是“化学-人类的生活,人类的未来”,北大校长周其凤作歌“化学有你、化学有我”.下列说法不正确的是( )
A.新能源汽车的推广与使用有助于减少能入肺颗粒(PM2.5颗粒)的产生
B.在食品中科学使用食品添加剂,有利于提高人类生活质量,硝酸盐、亚硝酸盐和二氧化硫都是现在常用的防腐剂
C.服用过量阿司匹林会出现酸中毒,应立即停药并静脉滴注碳酸氢钠溶液
D.近年来天津地区在光纤传输信息领域中取得突破性发展,光纤的主要成分是高纯度的单质硅难度: 中等查看答案及解析
-
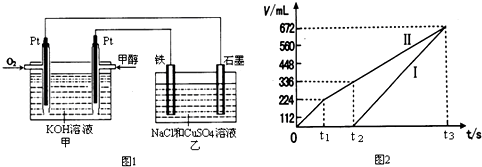
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
A.原子半径的大小顺序为:甲>乙>丙>戊
B.氢化物的稳定性:乙>丁;氢化物的沸点:丁>乙
C.元素甲与元素丙的最高正化合价之和的数值等于8
D.元素戊的氧化物对应的水化物的酸性一定比丁的强难度: 中等查看答案及解析
-
下列有关实验现象或结论的描述不正确的是( )
A.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色溶液,利用此反应可检验Fe2+
B.实验室制备乙炔时,使用硫酸铜溶液除去乙炔气体中的杂质
C.常温下将5mL 0.1 mol/L Na2S2O3溶液、5mL 0.01 mol/L Na2S2O3溶液分别与5mL 0.1 mol/L H2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响
D.检验淀粉水解的产物时,先向水解后的溶液中加入氢氧化钠溶液至弱碱性,再加入新制的银氨溶液并水浴加热难度: 中等查看答案及解析
-
下表是25°C时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 CH3COOH HClO H2CO3 Ka 1.8×10-5 3.0×10-8 Ka1=4.1×10-7
Ka2=5.6×10-11
A.物质的量浓度相同的CH3COOH和HClO溶液,pH前者比后者大
B.向0.1mol•L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COO-):c(CH3COOH)=9:5,此时所得溶液pH=5
C.相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D.向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32-难度: 中等查看答案及解析
-
下列相关说法中正确的是( )
A.1.0 mol•L-1的KNO3溶液中能大量存在:H+、Fe2+、Cl-、SO42-
B.一定条件下,足量铜与200g 98%的浓硫酸充分反应,转移电子数目为2NA
C.向淀粉碘化钾溶液滴几滴稀硫酸后溶液变为蓝色,反应的离子方程式为:4I-+O2+2H2O=2I2+4OH-
D.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3:2难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
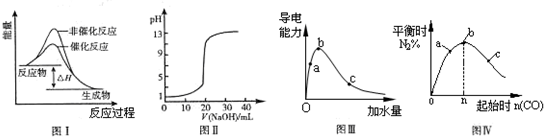
A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液所得到的滴定曲线
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D.图Ⅳ表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)△H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c难度: 中等查看答案及解析