-
下列说法正确的是( )
A. 白色污染是指橡胶造成的污染
B. 硫和氮的氧化物是形成酸雨的主要物质
C. 汽车尾气的排放是造成温室效应的罪魁祸首
D. 含磷洗涤剂的使用是造成水体富营养化的唯一原因
难度: 中等查看答案及解析
-
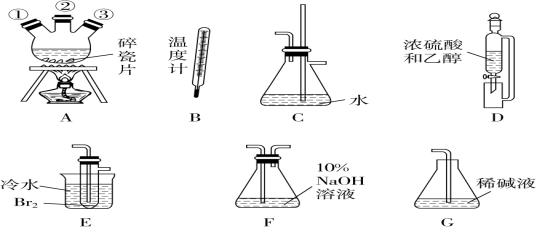
海藻中含有丰富的以离子形式存在的碘元素。下图是实验室从海藻中提取碘的流程的一部分。

下列判断正确的是( )
A.步骤①、③的操作分别是过滤、萃取
B.可用硝酸银溶液检验步骤②的反应是否进行完全
C.步骤③中加入的有机溶剂是裂化汽油或四氯化碳
D.步骤④的操作是过滤
难度: 简单查看答案及解析
-
 科学家最近在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是( )
科学家最近在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是( )A.充分燃烧等质量的X和甲烷,X消耗氧气较多
B.X中碳原子在同一平面上
C.X和乙烷类似,都容易发生取代反应
D.X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色
难度: 困难查看答案及解析
-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①③⑤ B.②③⑤
C.②⑤ D.①③④
难度: 中等查看答案及解析
-
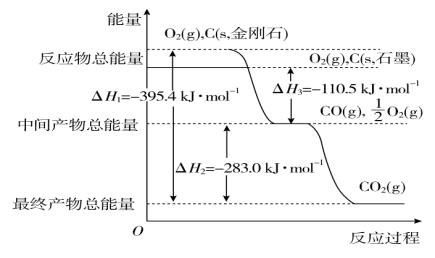
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变ΔH=ΔH1+ΔH2。满足上述条件的X、Y可能是( )

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③
C.①③④ D.①③④⑤⑥
难度: 困难查看答案及解析
-
下列各组变化中,化学反应的反应热前者小于后者的一组是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1;
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2;
②2H2(g)+O2(g)===2H2O(l) ΔH1;
H2(g)+O2(g)===H2O(l) ΔH2;
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2;
④CaCO3(s)===CaO(s)+CO2(g) ΔH1;
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2;
A.①② B.②③
C.③④ D.①②③
难度: 困难查看答案及解析
-
一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(s)+3B(g)
2C(g)达到平衡的说法中,正确的是( )
①C的生成速率和C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B ③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C的物质的量之比为1∶3∶2 ⑥混合气体的平均相对分子质量不变
A.②④⑤⑥ B.①③④⑥
C.①②④⑥ D.①③④⑤
难度: 中等查看答案及解析
-
柠檬烯是一种食用香料,其结构简式为
 ,有关柠檬烯的分析正确的是( )
,有关柠檬烯的分析正确的是( )A.一氯代物共有7种
B.分子中所有碳原子可能在同一平面上
C.和丁基苯(
)互为同分异构体
D.一定条件下,分别可以发生加成反应、取代反应、氧化反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.丙烷是直链烃,所以分子中3个碳原子也在一条直线上
B.丙烯所有原子均在同一平面上
C.
所有碳原子都在同一平面上
D.
 至少有16个原子共平面
至少有16个原子共平面难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用系统命名法命名有机物
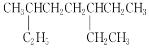 和
和 ,主链碳原子数均为7个
,主链碳原子数均为7个B.某烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有4种
C.碳原子数小于或等于8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有6种
D.经测定C3H7OH和C6H12组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是78%
难度: 中等查看答案及解析
-
有一反应:2A+B
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
难度: 困难查看答案及解析
-
某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s
0
50
150
250
350
n(PCl3)/mol
0
0.32
0.38
0.40
0.40
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.0064 mol/(L·s)
B.若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol/L,则反应的ΔH<0
C.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
D.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
难度: 困难查看答案及解析
-
下列说法中,能说明化学平衡一定向正反应方向移动的是( )
A.N2O4(g)
2NO2(g),改变某一条件后,气体颜色加深
B.H2(g)+I2(g)
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2
C.N2(g)+3H2(g)
2NH3(g),改变某一条件后,NH3的体积分数增加
D.2SO2(g)+O2(g)
2SO3(g),恒温恒压条件下,充入He
难度: 中等查看答案及解析
-
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
难度: 困难查看答案及解析
-
在某温度下,将3 mol A和2 mol B充入一密闭容器中,发生反应:aA(g)+B(g)
C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,B的转化率不发生变化,则B的转化率为( )
A.60% B.40%
C.24% D.4%
难度: 中等查看答案及解析
-
T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是( )

A.容器中发生的反应可表示为3X(g)+Y(g) =2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
难度: 困难查看答案及解析