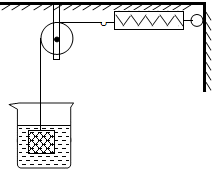
-
生活中的下列物质,都含有对人体健康构成威胁的有毒成分.其中,通过呼吸导致中毒的是( )
A.煤气(一氧化碳)
B.假酒(甲醇)
C.霉米(黄曲霉毒素)
D.假盐(亚硝酸钠)难度: 中等查看答案及解析
-
能证明分子在化学变化中可分的是( )
A.打开汽水瓶,有气体逸出
B.10mL水与10mL酒精混合,体积小于20mL
C.加热氧化汞得银白色汞与氧气
D.水蒸发为水蒸气难度: 中等查看答案及解析
-
用数轴表示某些化学知识直观、简明、易记.下列数轴表示错误的是( )
A.银、铜、铁的金属活动性强弱:
B.物质形成溶液的pH:
C.根据铁的含碳量,将其分成生铁和钢:
D.硫及其化合物与化合价的关系:难度: 中等查看答案及解析
-
下列有关说法符合科学事实的是( )
A.通过炼丹发明长生不老药
B.通过“点石成金”使贱金属变成贵黄金
C.纯净的水中不含任何物质
D.金刚石在空气里高温加热后消失了难度: 中等查看答案及解析
-
下列说法正确的是( )
A.制氧气一定要用二氧化锰作催化剂
B.所有的酸和碱都能使指示剂变色
C.检测某溶液的pH时,pH试纸要预先用水湿润
D.物质发生缓慢氧化时一定放出热量难度: 中等查看答案及解析
-
如图,是水的微观层次结构,图中右侧“O”表示( )

A.氢元素
B.氢原子
C.氧元素
D.氧原子难度: 中等查看答案及解析
-
下面是甲、乙、丙、丁四种常见金属与盐酸反应的比较示意图.以下说法错误的是( )

A.可将上述四种金属分为两类:一类能与酸反应,一类不能与酸反应
B.金属甲、乙、丙与盐酸的反应属于置换反应
C.若乙是金属Zn,则丙可能是Fe或Cu
D.四种金属的活动性顺序由强到弱可排列为甲、乙、丙、丁难度: 中等查看答案及解析
-
取实验室中部分变质的NaOH样品配成溶液,向其中滴加过量的稀盐酸,下列图象中能正确反映其中变化的是( )
A.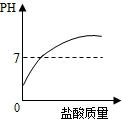
B.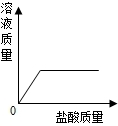
C.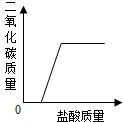
D.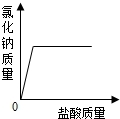
难度: 中等查看答案及解析
-
在验证“二氧化碳与水反应”的实验中,设计了四个小实验,对它们的认识不正确的是( )

A.实验Ⅰ只说明了石蕊遇酸变红色,与本实验没有任何关系
B.实验Ⅱ为对照实验,说明水不使石蕊变色
C.实验Ⅲ为对照实验,说明二氧化碳不使石蕊变色
D.实验Ⅳ为验证实验,说明二氧化碳与水发生了反应,而且生成了酸难度: 中等查看答案及解析
-
下列各实验不能达到实验目的是( )
A.用燃着的木条鉴别二氧化碳和氧气
B.加入适量的澄清的石灰水,以除去Ca(NO3)2溶液中的HNO3
C.用生石灰除去氢气中混有的水蒸气
D.用碳酸钠溶液鉴别澄清石灰水和Ba(OH)2溶液难度: 中等查看答案及解析
-
在一定条件下,下列转化不能由一步反应实现的是( )
A.CO→CaC03
B.HCl→NaCl
C.Fe→FeSO4
D.Ca(OH)2→NaOH难度: 中等查看答案及解析
-
核外电子数相同而质子数不同的一组微粒是( )
A.Na,Na+
B.H2O,NH3
C.H2,He
D.O2-,Ne难度: 中等查看答案及解析
-
若配制5%的双氧水,应取30%的双氧水(密度1.1g/cm3)与水的体积比为( )
A.1:11
B.11:2
C.2:11
D.11:1难度: 中等查看答案及解析
-
观察以下化学反应的微观示意图,下列说法不正确的是( )
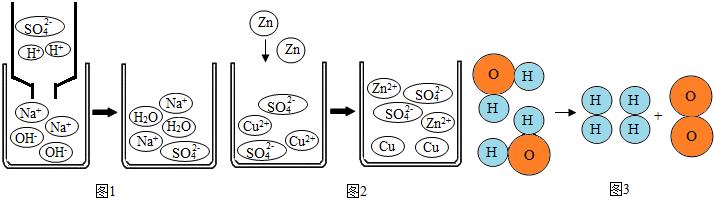
A.图1的反应中,微观上是H+和OH-生成水分子及Na+和SO42-生成Na2SO4分子的过程
B.图2中的反应,微观上是锌原子和铜离子生成锌离子和铜原子的过程
C.图3中的反应,微观上是分子的破裂,原子的重新组合生成新分子过程
D.上述所涉及的化学反应基本类型有复分解反应、置换反应、分解反应难度: 中等查看答案及解析
-
向下表的甲物质中逐滴加入相应的乙溶液直至过量,反应过程中生成气体或沉淀质量与加入乙的质量关系,能用右图曲线表示的是( )
序号 甲 乙 ① KOH和K2CO3的混合溶液 稀硝酸 ② Ag-Zn合金 稀硫酸 ③ 久置空气中的铝片 稀盐酸 ④ HCl和H2SO4的混合溶液 BaCl2溶液
A.①③
B.②④
C.①②
D.③④难度: 中等查看答案及解析
-
如图表示M、N两种固体物质的溶解度曲线.下列说法正确的是( )

A.20℃时,M的溶解度大于N的溶解度
B.P点表示t℃时M、N的溶解度相等
C.N的溶解度受温度影响比M大
D.阴影处M、N均为饱和溶液难度: 中等查看答案及解析
-
小军用下图形式对所学知识进行归纳,其中甲包含乙、丙、丁…下列关系中,有错误的一组是( )
甲 乙、丙、丁… A 盐 食盐、纯碱、高锰酸钾… B 合金 不锈钢、焊锡、生铁… C 溶液 碘酒、糖水、生理盐水… D 干燥剂 石灰石、浓硫酸、生石灰… 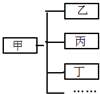
A.A选项
B.B选项
C.C选项
D.D选项难度: 中等查看答案及解析
-
将10g质量分数为20%的氢氧化钠溶液与20g质量分数为10%的硫酸溶液混合后,所得溶液不能与下列物质发生反应的是( )
A.CuCl2
B.Na2CO3
C.CO2
D.Ba(NO3)2难度: 中等查看答案及解析
-
氧化钠溶于水发生如下反应:Na2O+H2O 2NaOH.在NaOH的饱和溶液中,投入一小块Na2O固体,充分搅拌后,静止一段时间,恢复至原来温度.下列有关说法正确的是( )
A.溶液中NaOH的质量分数不变
B.溶液中NaOH的溶解度不变
C.溶质的质量不变
D.溶剂的质量不变难度: 中等查看答案及解析