-
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
难度: 简单查看答案及解析
-
下列叙述,能肯定判断某化学平衡发生移动的是
A.混合物中各组分的浓度改变 B.混合物的密度改变
C.正、逆反应速率改变 D.反应物的转化率改变
难度: 简单查看答案及解析
-
在2A + B = 3C + 4D的反应中,下列表示该反应的化学反应速度最快的是
A.v (A) = 0.5 mol/(L·s) B.v (B) = 0.3 mol/(L·s)
C.v (C) = 0.8 mol/(L·s) D.v (D) = 1.0 mol/(L·s)
难度: 简单查看答案及解析
-
已知溶液中存在Cr2O72- + H2O
2CrO42- + 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
A.黄色加深 B.橙色加深 C.颜色不变 D.颜色褪去
难度: 简单查看答案及解析
-
对于可逆反应,2SO2 (g)+ O2(g)
2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
A.增大SO2的转化率K值一定增大 B.减小压强K值减小
C.K值越大SO2转化率越大 D.升高温度K值增大
难度: 简单查看答案及解析
-
在一个密闭烧瓶中,在25℃时存在着平衡:2NO2
N2O4 △H<0,如把烧瓶置于100℃的沸水中,则下列几项性质中:①颜色 ②平均分子量 ③质量 ④压强 ⑤密度,其中不会改变的是
A.①和③ B.③和⑤ C.④和⑤ D.②和④
难度: 简单查看答案及解析
-
下列热化学方程式或离子方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H= -38.6kJ·mol-1
C.氯化镁溶液与氨水反应: Mg2++2OH-=Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-=2AlO2-+H2O
难度: 简单查看答案及解析
-
下列说法不正确的是
A.能够发生有效碰撞的分子叫做活化分子
B.加入反应物,活化分子百分数增大.化学反应速率增大
C.升高温度,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
难度: 简单查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
容器编号
起始时各物质物质的量/mol
达平衡时体系
能量的变化
N2
H2
NH3
①
1
3
0
放出热量:23.15kJ
②
0.9
2.7
0.2
放出热量:Q
下列叙述错误的是
A.容器②中达平衡时放出的热量Q=23.15 kJ
B.平衡时,两个容器中NH3的体积分数均为
C.容器①、②中反应的平衡常数相等
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
难度: 简单查看答案及解析
-
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)
3C(g)+2D(g),达到平衡状态的是
A.混合气的平均相对分子质量不再改变
B.反应器内A、B、C、D物质的量比为1:3:3:2
C.容器内密度不随时间变化而变化
D.生成 1mol A同时有3 mol C被消耗
难度: 简单查看答案及解析
-
已知:4NH3(g)+5O2(g)
4NO(g)+6H2O(g),△H=-1025 kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
A. B.
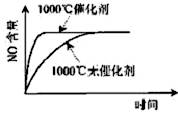
C. D.
难度: 简单查看答案及解析
-
如下图所示,左侧注射器吸入10mLNO2 、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)
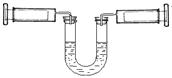
A.压缩后U型管内两侧液面仍然保持水平
B.对于2NO2N2O4平衡体系,向生成N2O4的方向移动
C.左侧气体颜色先变深后逐渐变浅(比原来深)
D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平
难度: 简单查看答案及解析
-
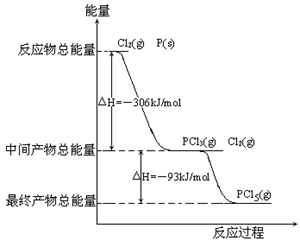
根据碘与氢气反应的热化学方程式 I2(g)+ H2(g)
2HI(g) △H=- 9.48 kJ·mol-1
(ii) I2(s)+ H2(g)
2HI(g) △H= +26.48kJ·mol-1 下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 简单查看答案及解析
-
高温下,某反应达平衡,平衡常数K=
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.恒温恒容下,增大压强,H2浓度一定减小 B.该反应的焓变为正值
C.该反应化学方程式为CO+H2O=CO2+H2 D.升高温度,逆反应速率减小
难度: 简单查看答案及解析
-
右图是373K时N2与H2反应过程中能量变化的曲线图。

下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2
2NH3 △H=-92kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1
难度: 简单查看答案及解析
-
已知H2(g)+Br2(l)=2HBr(g);△H=-72KJ/mol,蒸发1mol Br2(l)需要吸收的能量为30KJ,其他的相关数据如右表:

则表中a为
A.404 B.260 C.230 D.200
难度: 简单查看答案及解析
-
下列事实中,不能用勒沙特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.工业合成氨时选择铁做催化剂能极大加快反应速率
C.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
难度: 简单查看答案及解析
-
下列可逆反应中,正反应是吸热反应的是
A.PCl3(l)+Cl2(g)
PCl5(s) 降温,PCl3转化率增大
B.NO2(g)+SO2(g)
NO(g)+SO3(g) 降温,SO3的体积分数增加
C.2NO2 (g)
2NO(g)+O2(g) 降温,颜色加深
D.CS2(l)+2H2O(g)
CO2(g)+2H2S(g) 升温,CO2的平衡浓度增大
难度: 简单查看答案及解析
-
在气相条件下(T=500 K),有相同体积的甲、乙两容器,甲容器充入1 g SO2、l gO2,乙容器充入2 g SO2、2g O2则下列叙述中正确的是
A.化学反应速率:乙>甲 B.平衡后SO2的浓度:乙>甲
C.SO2转化率:乙<甲 D.平衡后O2的体积分数:乙>甲
难度: 简单查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时B的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减小了
C.物质B的体积分数增加了 D.a>b
难度: 简单查看答案及解析
-
有某可逆反应aA(g)+bB(g)
cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响。
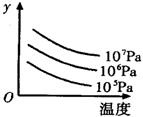
下列判断正确的是
A.a+b<c时,y轴表示平衡混合气中C的质量分数
B.a+b<c时,y轴表示平衡混合气的平均摩尔质量
C.△H>0时,y轴表示达到平衡时B的转化率
D.△H>0时,y轴表示达到平衡时A的浓度
难度: 简单查看答案及解析
-
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。
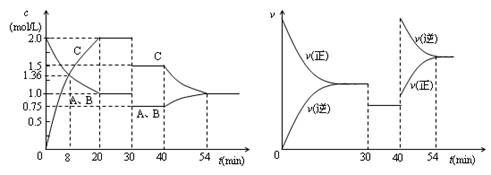
下列说法中错误的是
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间三种气体的物质的量没有变化
难度: 简单查看答案及解析
-
(14分)有如下化学反应:2A(g)+B(g)
2C(g),△H<0。
(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为____________________________;2s时物质B的浓度为____________________;
(2)若将4 mol A和2 mol B加入体积不变的容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的物质的量_________(填“增大”、“减小”或“不变”),若要使A的物质的量再达到与原平衡状态相同,可采取的措施有_。(填一种措施即可)
(3)下图是一定条件下该反应过程中,体系内各物质浓度的变化情况。t2时曲线发生变化的原因是_______________________________ ,若在t4时将B的浓度增大0.l mol·L-1,在t5时刻到达新平衡。请在图中画出各物质浓度的变化情况。
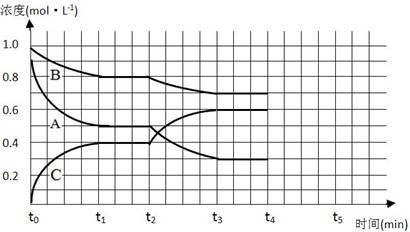
难度: 简单查看答案及解析
-
(6分)工业合成氨与制备硝酸一般可连续生产,流程如下:
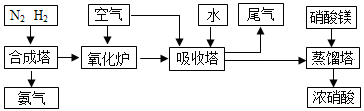
(1)在合成氨的反应中,改变反应条件,会使平衡发生移动。如下图像表示随条件改变,氨气的百分含量的变化趋势。
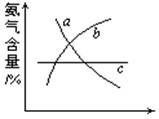
当横坐标为压强时,变化趋势正确的是(选填字母序号)_________,
当横坐标为温度时,变化趋势正确的是(选填字母序号)________。
(2)如图所示三个容积相同的容器①、②、③,若起始温度相同,
分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,达到平衡时各容器中NH3物质的百分含量由小到大的顺序为________(填容器编号)
难度: 简单查看答案及解析
-
(10分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.
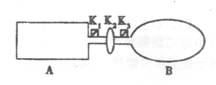
关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g)
N2O4(g) △H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A)________V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将________(填“变大”、“变小”或“不 变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将________。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将________。
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,________中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率(写出计算过程)
难度: 简单查看答案及解析