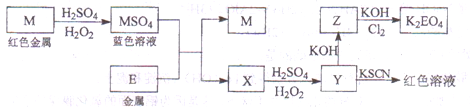
-
要证明某溶液中不含Fe3+而可能含有Fe2+.进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液.
A.③①
B.③②
C.①③
D.①②③难度: 中等查看答案及解析
-
亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH.下列有关说法正确的是( )
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等
D.此法储氢和钢瓶储氢的原理相同难度: 中等查看答案及解析
-
在一无色未知液中已检出有Al3+存在,在此溶液中能大量共存的离子组是( )
A.Na+、NH4+、NO3-、Cl-
B.K+、Na+、HCO3-、Br-
C.Na+、H+、NO3-、S2-
D.K+、Fe3+、NO3-、Cl-难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是( )
A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀难度: 中等查看答案及解析
-
0.001mol金属放入10mL 0.1mol/L某酸溶液中,产生22.4mL氢气(标准状况),下列情况中一定不可能的是( )
A.一价金属和一元酸
B.二价金属和二元酸
C.三价金属和二元酸
D.二价金属和三元酸难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应,用CuSO4溶液和“某物质”在40-50℃时反应可产生它.下列有关叙述中错误的是( )
A.这“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl难度: 中等查看答案及解析
-
在相同条件下,一个容器充满NO,另一个容器充满N2和O2,两个容器的体积相同,则两个容器内的气体有相同的( )
A.原子数
B.电子数
C.中子数
D.质量难度: 中等查看答案及解析
-
向含有FeCl2、FeCl3、AlCl3、NH4Cl的混合溶液中先加入过量Na2O2固体,微热搅拌后再加入过量盐酸,溶液中阳离子数目变化最小的是( )
A.Fe2+
B.Fe3+
C.Al3+
D.NH4+难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
①C、CO②AlCl3、Al(OH)3③Fe、Fe(NO3)2④Na2CO3、NaHCO3.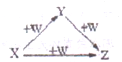
A.①②③④
B.①②
C.③④
D.①③难度: 中等查看答案及解析
-
实现Al3++3AlO2-+6H2O=4Al(OH)3↓,正确的做法是( )
A.向铝盐溶液中不断加入纯碱溶液
B.向铝盐溶液中不断加入小苏打溶液
C.向烧碱溶液中不断滴入铝盐溶液
D.向铝盐溶液中不断滴入烧碱溶液难度: 中等查看答案及解析
-
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.
B.(2b-a)mol/L
C.
D.(10b-5a)mol/L难度: 中等查看答案及解析
-
下列各物质中,不能由组成它的两种元素的单质直接化合得到的是( )
A.FeS
B.FeCl2
C.FeCl3
D.Fe3O4难度: 中等查看答案及解析
-
今有浓度均为3mol•L-1的盐酸和硫酸各100mL,分别加入等质量的Fe粉,反应完毕后生成气体的质量之比为3:4,则加入盐酸中的铁粉的质量为( )
A.5.6g
B.8.4g
C.11.2g
D.16.8g难度: 中等查看答案及解析
-
下表中评价合理的是( )
选项 化学反应及其离子方程式 评价 A Fe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2↑+8H2O 正确 B 向碳酸镁中加入稀盐酸:CO32-+2H+═CO2+H2O 错误,碳酸镁不应该写成离子形式 C 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ 正确 D FeBr2溶液与等物质的量的Cl2反应:
2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2错误,Fe2+与Br-的化学计量数之比应为1:2
A.A正确
B.B正确
C.C正确
D.D正确难度: 中等查看答案及解析
-
下列反应的离子方程式中错误的是( )
A.氯化铝溶液中加入过量的氨水Al3++3NH3•H2O=Al(OH)3↓+3NH4+
B.铁片放入过量的稀硝酸中3Fe+8H++2NO3-=3Fe2++2NO2↑+4H2O
C.将铝片放入过量NaOH溶液中2Al+2OH+2H2O=2AlO2-+3H2↑
D.偏铝酸钠与过量盐酸反应AlO2-+4H+=Al3++2H2O难度: 中等查看答案及解析
-
高中课本中有多处“科学探究”,下列说法正确的是( )
A.将Fe(OH)3胶体和泥水分别进行过滤,分别得到Fe(OH)3沉淀和泥土
B.将铝箔在酒精灯上加热至熔化,观察熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝
C.铁粉与水蒸气反应的化学方程式:2Fe+3H2O(g)Fe2O3+3H2
D.食醋浸泡有水垢的暧壶或水壶,清除其中的水垢的离子方程式:2H++CaCO3=Ca2++H2O+CO2↑难度: 中等查看答案及解析