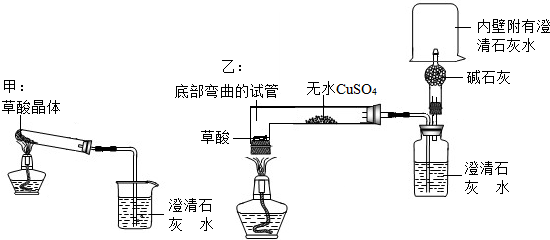
-
室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为40%),另一瓶为10%的溶液,下列实验操作中,无法区分这两种溶液的是( )
A.加一定量水
B.加入少量硝酸钾固体
C.略降低温度
D.室温时蒸发少量水难度: 中等查看答案及解析
-
现代医学证明,人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着.碱式磷酸钙的化学式中除钙离子外,还含有一个氢氧根离子和三个磷酸根离子,则其化学式正确的是( )
A.Ca2(PO4)3(OH)
B.Ca3(PO4)3(OH)
C.Ca4(PO4)3(OH)
D.Ca5(PO4)3(OH)难度: 中等查看答案及解析
-
2004年3月,我国在世界上首先用二氧化碳作为原料生产出了一种无毒、阻气、透明、全降解的塑料二氧化碳聚合物.有关生产和使用的说法错误的是( )
A.可以减少二氧化碳的排放,减缓温室效应
B.可以充分利用丰富的廉价资源生产塑料
C.该塑料可广泛应用于医药和食品包装、一次性餐具等方面
D.该塑料的应用可减少臭氧层的破坏难度: 中等查看答案及解析
-
下列叙述不符合化学史实的是( )
A.首先发现并制得氧气的是法国化学家拉瓦锡
B.在19世纪,首先提出分子概念的是意大利科学家阿伏加德罗
C.近代原子学说是由英国科学家道尔顿提出的
D.我国是世界上最早使用湿法冶金的国家,早在西汉就开始用于冶炼金属难度: 中等查看答案及解析
-
向一定量的饱和的NaOH溶液中加入少量Na2O固体,恢复到原来温度时,下列说法中正确的是( )
A.溶液中的Na+总数不变
B.溶剂的质量不变
C.溶质的质量分数不变
D.溶液的质量不变难度: 中等查看答案及解析
-
质子和中子都是由u夸克和d夸克组成,u夸克带电量为
e,d夸克带电量为-
e,e为基元电荷.下列论断可能正确的是( )
A.质子由1个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
B.质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成
C.质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
D.质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成难度: 中等查看答案及解析
-
氧化铜被下列物质还原时,均可得到金属铜.若反应中生成气体的质量与试管中固体减少的质量相等,则反应中所用的还原剂是( )
A.氢气
B.碳
C.一氧化碳
D.氨气难度: 中等查看答案及解析
-
配制一定溶质质量分数的NaOH溶液时,造成所配制溶液的溶质质量分数偏高的原因可能是( )
A.所用NaOH已潮解
B.用量筒量取水时,俯视水面刻度线来读取体积读数
C.托盘天平的左右托盘上各放一张纸,调整天平至平衡后,将NaOH固体放在纸上称量
D.用带游码的托盘天平称量NaOH固体质量时,误将砝码放在左盘,被称量物放在右盘难度: 中等查看答案及解析
-
将Mg、Al、Zn分别放入相同溶质质量分数的盐酸中,反应完成后,放出的氢气质量相同,其可能的原因是( )
A.放入的三种金属质量相同,盐酸足量
B.放入的Mg、Al、Zn的质量比为12:9:32.5,盐酸足量
C.盐酸的质量相同,放入足量的三种金属
D.放入的盐酸质量比为3:2:1,反应后无盐酸剩余难度: 中等查看答案及解析
-
工厂排放的废硫酸,拟选用下列物质与之中和.
如果要求花最少的钱来中和同样量的废硫酸则应选择( )物质 CaCO3 NaOH Ca(OH)2 NH3 市场参考价(元/kg) 1.8 11.5 2.0 6.5
A.Ca(OH)2
B.CaCO3
C.NH3
D.NaOH难度: 中等查看答案及解析
-
“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲得到的产物,即原子的利用率为100%.在用丙炔(C3H4)合成2-甲基丙烯酸甲酯(C5H8O2)过程中,欲使原子的利用率达到100%,在催化剂作用下,还需要的其他反应物是( )
A.CO2和CH3OH
B.CO2和H2
C.H2和CO
D.CH3OH难度: 中等查看答案及解析
-
将一定量铝粉和氧化铜混合加热,反应的化学方程式为3CuO+2Al
3Cu+A12O3.反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中.下列叙述的现象中,能够说明氧化铜没有完全反应的是( )
①加入稀硫酸后,有气泡生成
②加入稀硫酸后,没有气泡生成
③加入稀硫酸后,溶液中有红色不溶物质
④插入溶液中的铁片表面有红色物质析出.
A.只有④
B.②③
C.③④
D.①③④难度: 中等查看答案及解析
-
如图所示,夹子开始处于关闭状态,将液体 A滴入试管②,打开夹子,可发现试管①内的水立刻沸 腾了.则液体A和气体B的组合可能的是下列的( )
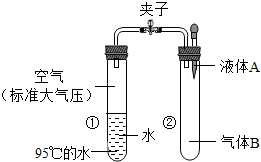
A.酒精、氧气
B.水、一氧化碳
C.硝酸银溶液、氯化氢
D.氢氧化钠溶液、二氧化碳难度: 中等查看答案及解析
-
已知氧化还原反应中存在如下关系:强氧化剂+强还原剂→弱还原剂+弱氧化剂,现有下列三个能反应的式子:2W-+X2→2X-+W2;2Y-+W2→2W-+Y2;2X-+Z2→2Z-+X2
以上反应均在同温、同压、同浓度下进行,正确的结论是( )
A.氧化性是:Y2>X2
B.还原性是:Y->Z-
C.2Z-+Y2→2Y-+Z2的反应能够进行
D.在X-、Y-、W-、Z-中X-的还原性最强难度: 中等查看答案及解析
-
向Na2CO3溶液里滴加盐酸,开始时无气泡产生,后来才有气泡产生;向盐酸里滴加Na2CO3溶液时,立即就有气泡产生.这说明( )
A.Na2CO3跟盐酸不反应
B.产生的气泡是挥发出来的氯化氢气体
C.Na2CO3过量时,主要发生的反应可能是Na2CO3+HCl=NaHCO3+NaCl
D.盐酸过量时,主要发生的反应是Na2CO3+2HCl=2NaCl+H2O+CO2↑难度: 中等查看答案及解析
-
下列各图所示装置的气密性检查中,漏气的是( )
A.
B.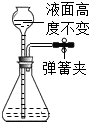
C.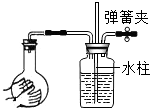
D.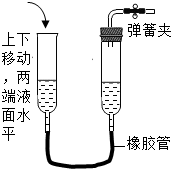
难度: 中等查看答案及解析
-
某城市有甲、乙两工厂排放污水,污水中各含有下列6种离子中的3种(两厂不含相同离子):Ag+、Ba2+、Na+、C1-、SO42-、NO3-.若两厂单独排放都会造成严重的水圬染,如将两厂的污水按一定比例混合,沉淀后污水便会变得无色澄清且只含硝酸钠而排放,污染程度会大大降低.关于污染源的分析,你认为正确的是( )
A.SO42-和NO3-可能来自同一工厂
B.C1-和NO3-一定不在同一工厂
C.Ag+和Na+可能在同一工厂
D.Na+和NO3-来自同一工厂难度: 中等查看答案及解析
-
将一严重锈蚀而部分变成铜绿[Cu2(OH)2CO3]的铜块研磨成粉末,在空气中充分灼烧成CuO,固体质量的变化情况可能是( )
A.增重30%
B.增重10%
C.不变
D.减轻30%难度: 中等查看答案及解析
-
取某二价金属的单质3.5g放入到50g质量分数为18.25%的盐酸中,充分反应后金属仍有剩余;若取2.5g该金属放入等质量的上述盐酸中,充分反应后,该金属没有剩余.则该金属的相对原子质量可能为( )
A.24
B.40
C.56
D.65难度: 中等查看答案及解析
-
定期公布的空气质量报告中,一般不涉及( )
A.二氧化硫
B.可吸入颗粒物
C.氮氧化合物
D.二氧化碳难度: 中等查看答案及解析