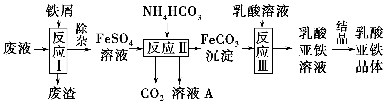
-
下列说法正确的是 ( )。
A.过氧化钠、烧碱、纯碱分别属于碱性氧化物、碱、盐
B.Cu、Al、Na可以分别用热还原法、热分解法和电解冶炼
C.在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉可以溶解
D.除去FeCl2溶液中少量的FeCl3,可加入Cu
难度: 中等查看答案及解析
-
下列类推正确的是 ( )。
A.CaCO3与稀硝酸反应生成CO2,CaSO3也能与稀硝酸反应生成SO2
B.铜在氯气中剧烈燃烧生成二价铜,铜也能在硫蒸气中剧烈燃烧生成二价铜
C.锌可以与溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置换反应
D.钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气
难度: 中等查看答案及解析
-
某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示。
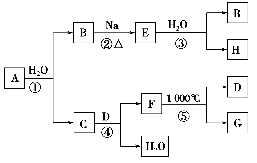
下列说法正确的是 ( )。
A.反应①、③中H2O均是还原剂
B.工业上常用C的悬浊液与Cl2反应制取漂白粉
C.D与H溶液反应后所得溶液的溶质成分有三种可能
D.电解F与盐酸反应后的溶液以制取单质A
难度: 中等查看答案及解析
-
下列是部分矿物资源的利用及产品流程,有关说法不正确的是( )。

A.粗铜电解精炼时,粗铜做阳极
B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C.黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用做冶铁的原料
D.粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
难度: 中等查看答案及解析
-
下列转化关系在给定条件下不能实现的是 ( )。

A.①②③ B.②③⑤ C.③④⑤ D.①②③④
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )。
A.稀硫酸与铁反应:2Fe+6H+=2Fe3++3H2↑
B.2 mol·L-1的AlCl3溶液和7 mol·L-1的NaOH溶液等体积均匀混合:2Al3++7OH-=Al(OH)3↓+AlO2—+2H2O
C.Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O
D.NaHCO3的水【解析】
HCO3—+H2OCO32—+H3O+
难度: 中等查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
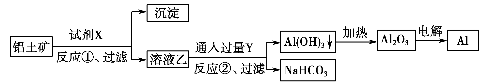
下列叙述正确的是( )。
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
难度: 中等查看答案及解析
-
海水是重要的资源。可以制备一系列物质(见图)。
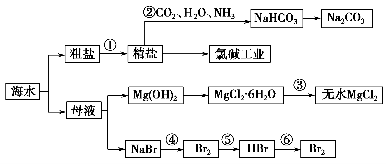
下列说法正确的是 ( )。
A.步骤②中,应先通NH3,再通CO2
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的SO32—、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
难度: 中等查看答案及解析