-
将元素周期表原先的主、副族族号取消,从左往右改为18列,碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是
A.不仅有第2列元素的原子最外层有2个电子
B.第3~12列元素全为金属
C.第3列元素种类最多
D.第15、16、17列元素都是非金属元素
难度: 困难查看答案及解析
-
金属钛对人体无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列
和
的说法中不正确的是
A.
和
属于同种元素
B.
和
的性质几乎相同
C.
的相对原子质量约为48
D.
与
为不同一核素,互为同位素
难度: 困难查看答案及解析
-
我国最新报导的高超导体中,铊(Tl)是其中之一,已知位于第六周期第ⅢA族,关于铊的说法,可能错误的是:
A.是银白色金属 B.Tl(OH)3 有两性
C.与稀盐酸反应生成盐酸盐 D.铊的金属性强于铝的金属性
难度: 中等查看答案及解析
-
元素性质呈周期性变化的原因是
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.原子核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
难度: 中等查看答案及解析
-
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径A>B>D>C
B.原子序数d>d>b>a
C.离子半径C>D>B>A
D.单质的还原性A>B>D>C
难度: 中等查看答案及解析
-
下列说法错误的是
A.在共价化合物中一定含有共价键
B.由非金属元素组成的化合物一定是共价化合物
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中的共价健一定是非极性键
难度: 中等查看答案及解析
-
下列关于元素周期表的说法中,正确的是
A.元素族序数一定等于它的最外层电子数
B.同周期元素的电子层数都相同
C.最外层电子数相同的元素都在同一族
D.周期表是按相对原子质量逐渐增大的顺序从左到右排列的
难度: 中等查看答案及解析
-
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
难度: 中等查看答案及解析
-
A、B、C均为周期表中的短周期的元素,它们在周期表的位置如下图。已知B、C两元素在周期表中族数之和是A元素族数的2倍;B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C所在的一组是
A.Be、Na、Al B.P、O、Cl C.O、P、Cl D.C、Al、P
难度: 中等查看答案及解析
-
化学用语在化学学习中有着重要的作用.下列有关化学用语使用正确的是
A.CO2的电子式
B.Cl-的结构示意图
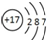
C.HCl的电子式
D.质量数为37的氯原子
难度: 中等查看答案及解析
-
下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是
①微粒半径:S2->Cl->S>Cl
②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>Br>I.
A.①⑤ B.①③④ C.②④⑥ D.⑥
难度: 中等查看答案及解析
-
磷和氮同为VA族元素,它们对应的化合物在结构上和性质上有许多相似之处。下列对PH4I的说法中,不正确的是
A.它是离子化合物
B.它的热稳定性好
C.它能与强碱发生反应
D.其溶液可与AgNO3溶液发生反应
难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为36,原子最外层电子数之和为14。其中A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。下列叙述正确的是
A.一定条件下,B单质能置换出D单质,C单质能置换出A单质
B.D元素处于元素周期表中第3周期第IVA族
C.A、C的最高价氧化物均为离子化合物
D.四种元素的原子半径:A>B>D>C
难度: 中等查看答案及解析
-
电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是: Zn + 2OH- -2e-==ZnO + H2O Ag2O +H2O + 2e-==2Ag +2 OH- ,下列判断正确的是
A.锌为正极,Ag2O为负极 B.锌为负极,Ag2O为正极
C.原电池工作时,正极区溶液pH减小 D.原电池工作时,负极区溶液pH增大
难度: 中等查看答案及解析
-
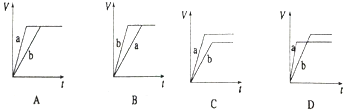
等质量的两份锌粉a、b,分别加入过量的稀硫酸,同时向a中加入少量CuSO4溶液,下列图中表示产生H2的体积(V)与时间(t)的关系正确的是
难度: 中等查看答案及解析
-
某元素一种同位素的原子的质子数为m,中子数为n,则下列说法正确的是
A.这种元素的原子量为m B.不能由此确定该元素的相对原子质量
C.(m+n)可写在该元素符号的左上角 D.核内中子的总质量小于质子的总质量
难度: 中等查看答案及解析
-
(1)有下列七种物质:A O2, B 冰,C 氯化铵,D NH3,E 烧碱,F MgCl2,G Na2O2,H Ar其中,只含有极性键的是 (填序号,下同),含非极性键的是: ,是离子化合物的是 ;
(2)有下列四组物质:①H2和T2,②35Cl和37Cl,③H2O和D2O,④O2和O3其中,互为同位素的是 (填序号,下同),互为同素异形体的是 。
(3)用电子式表示MgF2的形成过程 。
难度: 中等查看答案及解析


