-
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).对该反应的有关叙述正确的是( )
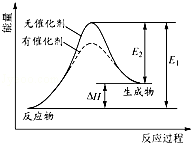
A.该反应的正反应为吸热反应
B.催化剂能改变反应的焓变
C.催化剂不能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
难度: 中等查看答案及解析
-
下列热化学方程式表达正确的是(△H的绝对值均正确)( )
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=﹣1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g)△H=﹣269.8kJ/mol (反应热)
D.2NO2=O2+2NO△H=+116.2kJ/mol (反应热)
难度: 中等查看答案及解析
-
有些化学反应反应速率很慢且副反应较多,测定这些反应的焓变可运用( )
A.盖斯定律 B.勒夏特列原理
C.阿伏加德罗定律 D.质量守恒定律
难度: 简单查看答案及解析
-
热化学方程式中的化学计量数表示( )
A.分子个数 B.原子个数 C.物质的质量 D.物质的量
难度: 简单查看答案及解析
-
热化学方程式C(s)+H2O(g)
CO(g)+H2(g);△H=+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.所有自发进行的化学反应都是放热反应
B.同一物质固、液、气三种状态的熵值相同
C.△H<0、△S>0的反应可自发进行
D.在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向
难度: 简单查看答案及解析
-
已知H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ•mol﹣1,则反应HCl(g)═
H2(g)+
Cl2(g)的△H为( )
A.+184.6kJ•mol﹣1 B.﹣92.3kJ•mol﹣1
C.﹣69.2kJ•mol﹣1 D.+92.3kJ•mol﹣1
难度: 简单查看答案及解析
-
对于A2+3B2⇌2C的反应来说,以下化学反应速率的表示中,反应速度最快的是( )
A.v(B2)=0.8 mol/(L•s) B.v(B2)=3mol/(L•min)
C.v(C)=0.6 mol/(L•s) D.v(A2)=0.4 mol/(L•s)
难度: 中等查看答案及解析
-
已知C(s)+CO2(g)
2CO(g)正反应为吸热反应,下列措施能使正反应速率加快的是( )
①增加少量C(s) ②升高温度 ③容器不变,再通入CO2 ④缩小体积增大压强.
A.①②③ B.①②③④ C.②③ D.②③④
难度: 中等查看答案及解析
-
关于有效碰撞理论,下列说法正确的是( )
A.活化分子间所发生的所有碰撞为有效碰撞
B.增大反应物浓度能够增大活化分子百分数,化学反应速率一定增大
C.升高温度,活化分子百分数增加,化学反应速率一定增大
D.增大压强,活化分子数一定增加,化学反应速率一定增大
难度: 中等查看答案及解析
-
决定化学反应速率快慢的主要因素是( )
A.温度 B.浓度 C.催化剂 D.反应物的性质
难度: 简单查看答案及解析
-
下列过程中,需要增大化学反应速率的是( )
A.钢铁腐蚀 B.食物腐败 C.塑料老化 D.工业合成氨
难度: 简单查看答案及解析
-
下列四种盐酸跟锌片反应,起始时反应速率最快的是( )
A.10℃20 mL 3 mol/L的盐酸 B.10℃40 mL 2 mol/L的盐酸
C.20℃20 mL 2 mol/L的盐酸 D.20℃10 mL 4 mol/L的盐酸
难度: 中等查看答案及解析
-
有一处于平衡状态的反应:X(g)+3Y(g)⇌2Z(g)(正反应为放热反应).为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥除去Z.
A.①④⑥ B.②③⑤ C.①③⑥ D.②③⑥
难度: 中等查看答案及解析
-
已知450℃时,反应H2(g)+I2(g)⇌2HI(g)的K=50,由此推测在450℃时,反应 2HI(g)⇌H2(g)+I2(g)的化学平衡常数为( )
A.50 B.0.02 C.100 D.无法确定
难度: 中等查看答案及解析
-
下列溶液中导电性最强的是( )
A.1L 0.1mol/L醋酸 B.1L 0.1mol/L硫酸
C.0.5L0.1mol/L盐酸 D.2L0.1moL/L的磷酸
难度: 中等查看答案及解析
-
下列物质中属于弱电解质的是( )
A.KOH B.H2SO4 C.CH3COOH D.NaCl
难度: 中等查看答案及解析
-
下列电离方程式中正确的是( )
A.NaHCO3═Na++H++CO32﹣ B.Fe2(SO4)3═Fe3++SO42﹣
C.KClO3═K++Cl﹣+3O2﹣ D.H2SO4═2H++SO42﹣
难度: 简单查看答案及解析
-
下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol•L﹣1HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1mol•L﹣1HNO2溶液稀释至100倍,pH约为3.1.
A.①④⑥ B.①②③④ C.①④⑤⑥ D.全部
难度: 中等查看答案及解析
-
下列溶液一定呈酸性的是( )
A.pH<7的溶液 B.c(H+)>c(OH﹣) 的溶液
C.pH>7的溶液 D.c(H+)<c(OH﹣) 的溶液
难度: 简单查看答案及解析
-
将pH试纸用蒸馏水湿润后,去测定某盐酸的pH,测得的pH将比实际( )
A.偏高 B.偏低
C.不变 D.三种情况均有可能
难度: 中等查看答案及解析
-
下列物质的水溶液中,呈碱性的是( )
A.CH3COONa B.Na2SO4 C.NH4Cl D.KAl (SO4)2
难度: 简单查看答案及解析
-
NH4Cl溶液中,下列叙述错误的是( )
A.c(NH4+)>c(Cl﹣)>c(OH﹣)>c( H+
B.c(Cl﹣)>c(NH4+)>c( H+)>c(OH﹣)
C.c(NH4+)+c( H+)=c(Cl﹣)+c(OH﹣)
D.c(NH4+)+c( NH3•H2O)=c(Cl﹣)
难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污 B.明矾可作净水剂
C.加热氯化铁溶液颜色变深 D.硫酸氢钠溶液显酸性
难度: 中等查看答案及解析
-
向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
A.AgCl的溶解度增大 B.AgCl的溶解度、Ksp均不变
C.Ksp(AgCl)增大 D.AgCl的溶解度、Ksp均增大
难度: 中等查看答案及解析