-
电子构型为
的元素是
A.ds区元素 B.过渡元素 C.主族元素 D.s区元素
难度: 简单查看答案及解析
-
下列原子或离子原子核外电子排布不属于基态排布的是
A. N: 1s22s22p3 B. S2-: 1s22s22p63s23p6
C. Na: 1s22s22p53s2 D. Si: 1s22s22p63s23p2
难度: 简单查看答案及解析
-
下列分子中,中心原子以sp3杂化且属于极性分子的是
A.CCl4 B.BF3 C.CO D.NH3
难度: 简单查看答案及解析
-
下列是几种原子的基态电子排布,电负性最大的原子是
A. 1s22s22p63s23p2 B.1s22s22p63s23p3
C. 1s22s22p4 C.1s22s22p63s23p64s2
难度: 简单查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是
A.CO2与SO2 B.CH4与NH3 C.BeCl2与BF3 D.C2H2与C2H4
难度: 简单查看答案及解析
-
镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是
A .氢氧化物呈两性 B . 单质与水反应放出氢气
C. 在化合物中呈+2价 D . 碳酸盐难溶于水
难度: 简单查看答案及解析
-
关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 简单查看答案及解析
-
下列化合物中,既有离子键,又有共价键的是
A.CaO B.SiO2 C.H2O D.Na2O2
难度: 简单查看答案及解析
-
第3周期元素形成的单质中,属于原子晶体的是
A.金刚砂 B.金刚石 C.单晶硅 D.二氧化碳
难度: 简单查看答案及解析
-
现有四种晶体,其离子排列方式如图所示,其中化学式不属AB型的是
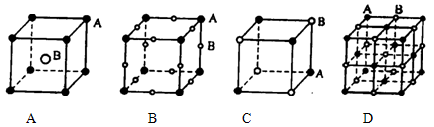
难度: 简单查看答案及解析
-
下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.熔点由高到低:Na>Mg>Al
C.硬度由大到小:金刚石>碳化硅>晶体硅
D.晶格能由大到小: NaF> NaCl> NaBr>NaI
难度: 简单查看答案及解析
-
已知含氧酸可用通式 (OH)nXOm来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是
A.H2SeO3 B.HMnO4 C.H3BO3 D.H3PO4
难度: 简单查看答案及解析
-
关于CO2说法正确的是
A.碳原子采取sp杂化 B.CO2晶胞是体心结构
C.干冰是原子晶体 D.CO2为极性分子
难度: 简单查看答案及解析
-
一个电子排布为1s22s22p63s23p1的元素最可能的价态是
A.+1 B.+2 C.+3 D.-1
难度: 简单查看答案及解析
-
下列各原子或离子的电子排布式错误的是
A. Na+: 1s22s22p6 B. F :1s22s22p5
C. O2—: 1s22s22p4 D. Ar: 1s22s22p63s23p6
难度: 简单查看答案及解析
-
依据元素周期表及元素周期律,下列推断正确的是
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl、HBr、HI的热稳定性依次增强
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M
难度: 简单查看答案及解析
-
关于晶体的下列说法正确的是
A.任何晶体中,若含有阳离子就一定有阴离子
B.原子晶体中只含有共价键
C.原子晶体的熔点一定比金属晶体的高
D.离子晶体中只含有离子键,不含有共价键
难度: 简单查看答案及解析
-
下列说法中,不符合ⅦA族元素性质特征的是
A.易形成—1价离子 B.从上到下原子半径逐渐减小
C.从上到下单质的氧化性逐渐减弱 D.从上到下氢化物的稳定性依次减弱
难度: 简单查看答案及解析
-
根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体。等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是
A. CO和N2 B. O3和SO2 C. CO2和N2O D. N2H4 和C2H4
难度: 简单查看答案及解析
-
如图是CaF2晶胞的结构。下列说法正确的是
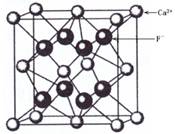
A.一个CaF2晶胞中含有8个Ca2+
B.一个CaF2晶胞中含有8个F-
C.在CaF2晶胞中Ca2+的配位数为4
D.在CaF2晶胞中F-的配位数为8
难度: 简单查看答案及解析
-
下图中,能正确表示基态硅原子的是
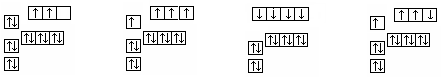
A B C D
难度: 简单查看答案及解析
-
下列的晶体中,化学键种类相同,晶体类型也相同的是
A.SO2与Si02 B.C02与H20 C.NaCl与HCl D.CCl4与KCl
难度: 简单查看答案及解析
-
某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是
A.1∶8 B.1∶4 C.1∶2 D.1∶1
难度: 简单查看答案及解析
-
下列化合物中含有手性碳原子的是
难度: 简单查看答案及解析
-
按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是
A.Fe B. Mg C.As D.Cu
难度: 简单查看答案及解析
-
下列各项所述的数字不是6的是
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
难度: 简单查看答案及解析
