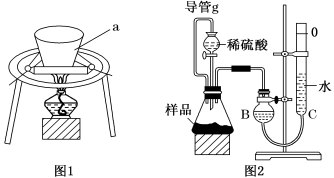
-
(8分)某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子
CO32-、SiO32-、AlO2-、Cl-
阳离子
Al3+、Fe3+、Mg2+、NH4+、Na+
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。

(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是_____ ,__ _,ab段发生反应的离子是________,bc段发生反应的离子方程式为__________。
(2)若Y是NaOH溶液,则X中一定含有的阳离子是_____ ,__ _,其物质的量之比为_________,ab段反应的离子方程式为____________。
难度: 困难查看答案及解析
-
(10分)工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是____ ___(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填选项字母)。
A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_________,_______。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________。
难度: 中等查看答案及解析
-
(两个选项符合题意,6分)双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是( )
A.该物质属于两性氢氧化物
B.该物质是Al(OH)3和Na2CO3的混合物
C.1 mol NaAl(OH)2CO3最多可消耗4 mol H+
D.该药剂不适合于胃溃疡患者服用
18-II(14分)铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.5 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:

(1)写出滴加NaOH溶液0~3 mL时发生反应的离子方程式:________________。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为______,其物质的量为____________。
(3)该钒土矿样中Al2O3的质量分数为________。
(4)用10.0 t“钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上在 极(填“阴”,“阳”)最多可制得金属铝________t。
难度: 困难查看答案及解析
-
(两个选项符合题意,6分)下列数据是对应物质的熔点,有关的判断错误的是( )
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920 ℃
97.8 ℃
1291 ℃
190 ℃
2073 ℃
-107 ℃
-57 ℃
1723 ℃
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
19-II(14分)如图为几种晶体或晶胞的构型示意图。
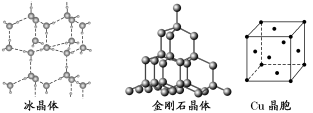
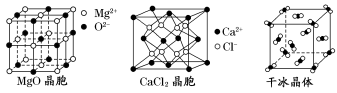
请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是____________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是_______________。
(4)每个铜晶胞中实际占有________个铜原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除因为H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_________。
难度: 困难查看答案及解析