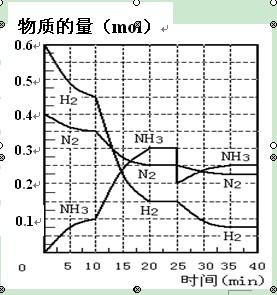
-
下列属于正在研究和开发的新能源有( )
①生物质能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A.①④⑤ B.②③⑥⑦ C.③⑥⑦⑧ D.①②④
难度: 简单查看答案及解析
-
某化学反应的△H= —122 kJ·mol-1,?S="+231" J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
难度: 简单查看答案及解析
-
在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.用热的纯碱溶液可增加去油污的能力
C.反应CO(g)+NO2(g)
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.选择合适的催化剂可使水在较低温度下分解
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百
分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 简单查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
C.用广泛pH试纸测得某溶液的pH为2.3
D.用托盘天平称量25.20g NaCl
难度: 简单查看答案及解析
-
20℃时H2S饱和溶液1 L,其浓度为0.1 mol / L,若要使溶液的pH和c(S2-)减小,可采取的措施是 ( )
A.加入适量的CuSO4固体 B.加入少量的氢氧化钠固体
C.通入适量的H2S气体 D.加入适量水
难度: 简单查看答案及解析
-
在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)
2Z(g), 不能标志该反应达平衡状态的是 ( )
A.容器内压强不随时间变化 B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1︰2︰2 D.X的生成速率和Z的生成速率之比为1︰2
难度: 简单查看答案及解析
-
已知:①C(s) +
O2(g) CO(g);△H =" –" 110.5 kJ · mol – 1
②C(s) + O2(g) CO2(g);△H =" –" 393.51 kJ · mol – 1
则反应:C(s) + CO2(g) 2CO(g)的△H为 ( )
A.– 283.01 kJ · mol – 1 B.+ 172.51 kJ · mol – 1
C.+ 283.01 kJ · mol – 1 D.+ 504.00 kJ · mol – 1
难度: 简单查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
从以上表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
难度: 简单查看答案及解析
-
反应mA(s)+nB(g)
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③x点比y点时的反应速率慢 ④n>p ⑤若升高温度,该反应的平衡常数增大
A.①②⑤ B.只有②④ C.只有②③ D.①③⑤
难度: 中等查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+
难度: 简单查看答案及解析
-
为了得到比较纯净的物质,使用的方法恰当的是( )
A.向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热条件下,蒸发得到NaOH晶体
B.加热蒸发
饱和溶液得纯净的
晶体
C.向
溶液中加入过量的氯水,加热蒸发得
晶体
D.向Fe2(SO4)3溶液加入足量
溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得
难度: 简单查看答案及解析
-
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )
A.平衡不移动 B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大 D.再达平衡时,正反应速率增大,逆反应速率减小
难度: 简单查看答案及解析
-
某二元酸(化学式用H2A表示)在水中的电离方程式为:H2A====H++HA- HA-
H++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( )
A.c(Na+)+ c(H+)= c(OH-)+ c(HA-)+ c(A2-)
B.c(Na+)+ c(OH-)= c(H+)+ c(HA-)
C.c(Na+)="2" c(A2-)+2 c(HA-)+2 c(H2A)
D.c(A2-) + c(HA-)="0.1" mol·L-1
难度: 简单查看答案及解析
-
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
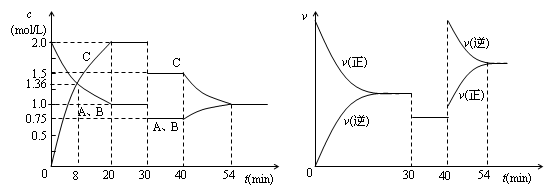
A.8min前A的平均反应速率为0.08mol/(L·s)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等4
难度: 简单查看答案及解析