-
下列叙述正确的是( )
A.化学反应一定只伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.电子数相同的粒子不一定属于同种元素
B.两个原子如果核外电子排布相同,一定属于同种元素
C.质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
D.所含质子数和电子数相等的粒子一定是原子
难度: 困难查看答案及解析
-
元素周期表中101—109号元素属于( )
A.锕系元素 B.金属元素 C.镧系元素 D.第六周期元素
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属元素才能形成含氧酸盐
C.主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同
D.非金属元素的最高价含氧酸都具有强氧化性
难度: 中等查看答案及解析
-
下列叙述正确的是( )
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A.只有②⑦ B.只有①⑦ C.只有⑦ D.只有①⑤⑦
难度: 困难查看答案及解析
-
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~18的元素中,满足上述关系的元素共有( )
A.3对 B.4对 C.6对 D.5对
难度: 中等查看答案及解析
-
A、B为短周期元素,二者可以组合成多种我们熟知的化合物。在这些化合物中,A与B的原子个数比为A:B=1:2。已知A的原子序数为n,B的原子序数是①n+2 ②n+3 ③n+4 ④n+5 ⑤n+8 ⑥n-5 ⑦n-6 ⑧n-8中的几种,其中不符合题目要求的是( )
A.①④ B.②⑧ C.③⑤ D.⑥⑦
难度: 困难查看答案及解析
-
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应形成离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
A.A、B、D不可能在同周期 B.D一定在第二周期
C.A、D可能在同一主族 D.C和D的单质可能化合为离子化合物
难度: 中等查看答案及解析
-
硼有两种天然同位素
B和
B,硼元素的近似相对原子质量为10.80,则
B的质量百分比是( )
A.80% B.大于80% C.小于80% D.无法计算
难度: 中等查看答案及解析
-
短周期元素X、Y,X元素原子的最外层电子数与次外层电子数的差值等于电子层数;Y元素原子的最外层电子数比X元素原子的最外层电子数多2,则X与Y所形成的化合物的化学式为( )
A.X3Y2 B.X2Y C.X2Y5 D.XY2
难度: 中等查看答案及解析
-
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是( )
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素丁在周期表中的位置为第3周期第VIA族
C.元素乙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是( )
A.Y的气态氢化物在一定条件下可被Q单质氧化
B.Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同
C.Q可分别与X、Y、Z、W形成化学键类型相同的化合物
D.Y的简单离子半径小于Z的简单离子半径
难度: 困难查看答案及解析
-
下表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素。下列说法正确的是( )
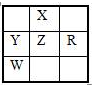
A.五种元素的原子最外层电子数一定都大于2
B.X、Z原子序数可能相差18
C.Z可能是氯元素
D.Z的氧化物与X单质不可能发生置换反应
难度: 中等查看答案及解析
-
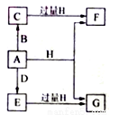
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
A.X、Y、Z一定都是非金属单质
B.X、Y、Z一定都是金属单质
C.X、Y、Z中至少有一种是非金属单质
D.X、Y、Z中至少有一种是金属单质
难度: 中等查看答案及解析
-
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)
CuSO4(s) + 5H2O(1),热效应为ΔH3。则下列判断正确的是( )
A.ΔH2>ΔH3 B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
难度: 中等查看答案及解析
-
CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3=c kJ·mol-1
则反应CO2(g)+CH4(g)
2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为( )
A.a+2b-c B.a+b-2c C.2a+2b-c D.a+2b-2c
难度: 中等查看答案及解析
-
用18g碳单质与标准状况下22.4LO2反应放出热量是Q1kJ,已知由碳单质生成1molCO2气体放热Q2kJ。下列说法不正确的是( )
A.由碳燃烧生成CO的热化学方程式是C(s)+1/2O2(g)=CO(g) △H=(Q1-0.5Q2)kJ/mol
B.由碳燃烧生成1molCO放出的热量是(Q1-0.5Q2)kJ
C.由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)=2CO(g) △H=(Q2-2Q1)kJ/mol
D.碳和CO2反应的热化学方程式是C(s)+CO2(g)=2CO(g) △H=(2Q2-2Q1)kJ/mol
难度: 中等查看答案及解析