-
下列叙述Ⅰ和Ⅱ均正确并用因果关系的是
选项
叙述Ⅰ
叙述Ⅱ
A
纳米铁粉有很好的吸附性
纳米铁粉可以高效地去除被污染水体中
的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子
B
硅胶可以和水发生化学反应
硅胶作袋装食品的干燥剂
C
SO3有毒
不能做食品防腐剂
D
肥皂水显碱性
肥皂水作蚊虫叮咬处的清洗剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 室温下,在水中的溶解度:丙三醇>苯酚>l一氯丁烷
B. 做衣服的棉和麻均与淀粉互为同分异构体
C. 用Na2CO3溶液不能区分CH3COOH 和CH3COOCH2CH3
D. 油脂在胶性或碱性条件下均能发生水解反应,且产物相间
难度: 中等查看答案及解析
-
下图是中学化学中常见的有机物转化关系,A可以提供生命活动所需要的能量,D是石油裂解气的主要成分,E可以发生银镜反应,F的相对分子质量为60,且分子中碳元素的质量分数为40%,下列说法错误的是

A. 写出D
E的化学方程式:2CH2=CH2+O2
2CH3CHO
B. 写出A 的分子式C6H12O6
C. ①的反应类型为水解反应
D. 与B含有相同官能团的同分异构体有2种
难度: 中等查看答案及解析
-
向含a mol NaClO的溶液通入b mol SO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是
A. 当0<b<a/3时:SO2+H2O+3ClO-=SO42-+2HClO+Cl-
B. 当b=a时,SO2+H2O+ClO-==2H++Cl-+SO42-
C. 当a/3≤b≤a时,反应后溶液中H+的物质的量: 0<n(H+)≤2bmol
D. 当0<b<a时,反应后溶液中ClO-、Cl-和SO42-物质的量之比为:(a-b)∶b∶b
难度: 困难查看答案及解析
-
下图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主旅元家下列说法中正确的是

A. W的原子序数不可能是X的原子序数的3倍
B. Z元素可能为金属
C. 四种元素的原子有可能均能与氢原子形成18电子分子
D. W的气态氢化物的稳定性一定比Y的强
难度: 中等查看答案及解析
-
下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是

A. 该电池与硅太阳能电池供电原理相同
B. 光照时,H+由a极室通过质子膜进入b极室
C. 夜间无光照时,a电极流出电子
D. 光照时,b极反应式是VO2++2OH--e-=VO2++H2O
难度: 中等查看答案及解析
-
常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如下,则下列说法不正确的是

A. 溶液的pH比较:x>y>z
B. 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
C. 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点
D. 该温度下,CH3COONa的Ka=10-4.75
难度: 困难查看答案及解析


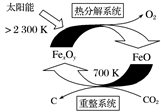
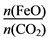 =6,则FexOy的化学式为________。
=6,则FexOy的化学式为________。



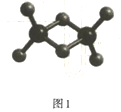
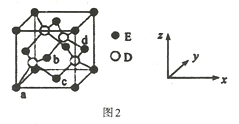
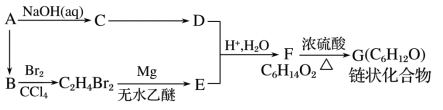
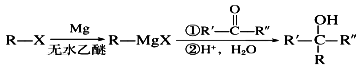 (R表示烃基,R’和R”表示烃基或氢)
(R表示烃基,R’和R”表示烃基或氢) _______
_______