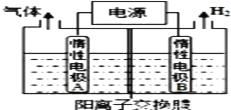
-
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 性质 |
| H2C2O4 | 189.5 | 有毒,具有腐蚀性,易溶于水,二元弱酸,比醋酸酸性强,100℃开始升华,157℃时开始分解.草酸与浓硫酸混合加热产生CO2,CO和H2O.草酸钙和草酸氢钙均为白色难溶物 |
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸与浓硫酸混合加热产物中含有CO2和CO(部分夹持仪器和加热装置省略)。
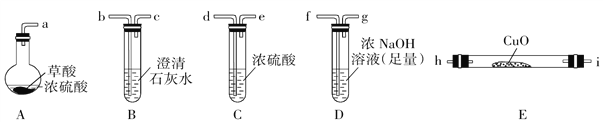
(1)仪器接口依次连接的合理顺序为a→____________________________.
(2)用上图提供的仪器和试剂做实验时,首次使用的装置B中出现白色浑浊,并不能说明草酸受热分解产物中一定有CO2,请你提出改进意见:__________________.
(3)利用改进后的装置进行实验时,要先加热______装置(填装置标号,下同)后加热______装置.
[实验二]利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中,迅速振荡混匀并开始计时,通过测定溶液褪色所需的时间来判断反应的快慢.该小组设计了如下的方案:
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ |
| 浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL |
| 1 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| 2 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| 3 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需满足的关系为n(H2C2O4)/n(KMnO4) ≥__________.
②探究温度对化学反应速率影响的实验编号是__________,探究反应物浓度对化学反应速率影响的实验编号是__________.
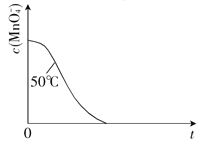
③已知50℃时c(MnO )-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO
)-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO )-t的变化曲线示意图并注明温度.
)-t的变化曲线示意图并注明温度.
-
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
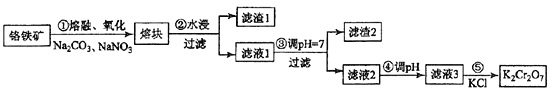
已知:铬元素在酸性条件下以重铬酸根离子的形式存在。回答下列问题:
(1)步骤①的主要反应为:FeO∙Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_____________________________。
Na2CrO4+Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_____________________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________________(填“大”或“小”),原因是________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________ (填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
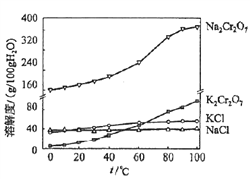
(5)某工厂用m1kg铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品m2kg,产率为_____________。
-
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| | | | | | | |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.容器内的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
②洗涤含SO2的烟气。
写出焦炭与水蒸气反应的热化学方程式:_______________。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式______________________;
②计算上述反应T1℃时的平衡常数K1=______________;
若T1<T2,则该反应的△H__________0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
-
四氧化三钴(Co3O4)纳米颗粒可以用于人造光合作用,以水和二氧化碳为原料制得甲醇燃料。回答下列问题:
(1)二氧化碳的水溶液中含有少量CO32-,CO32-的空间构型为____________。
(2)CO2,SiO2为同族元素的氧化物,SiO2熔点高的原因是__________________。
(3)甲醇分子中,中心原子的的杂化轨道类型为__________。甲醇易溶于水,其主要原因是____________________________________________________。
(4)Co3O4晶体结构中,O2-为立方紧密堆积;Co2+为四配位,填充于四面体空隙;Co3+填充于八面体空隙。Co2+的价层电子式为______;Co3O4晶体中Co3+的配位数为______。
(5)氧化亚钴与稀盐酸反应可生成紫红色六水合物(CoCl2·6H2O), 该反应的化学方程式为________________________________________________。
(6)四氧化三钴加热至900℃会分解生成氧化亚钴,氧化亚钴的晶体结构与氯化钠类似。若氧化亚钴晶体的晶胞边长为a pm,则两个紧邻的Co2+之间的距离为__________pm。
-
某新型有机酰胺化合物M在工业生产中有重要的应用,其合成路线如下;
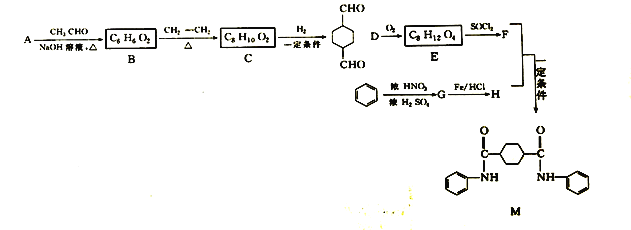
①A的相对分子质量为58,含氧的质量分数为0.552,已知核磁共振氢谱显示为一组峰,可发生银镜反应
其化回答下列问题:
(1)A的名称为_____________,C中含有官能团名称为__________________________
(2)F的结构简式为________________________________________
(3)B→C的反应类型为_________________,G→H的反应类型为____________
(4)F+H→M的化学方程式为_________________________________________________
(5)芳香族化合物W有三个取代基,是C的同分异构体,能与FeCl3溶液发生显色反应,0.5molW可与足量的Na反应生成1克H2,W共有______种同分异构体,其中核磁共振氢谱为五组峰的结构简式为_______________________
(6)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备 的合成路线_________________________________________________________________
的合成路线_________________________________________________________________
(b)、
(d)、
(p)的分子式均为C6H6,下列说法正确的是