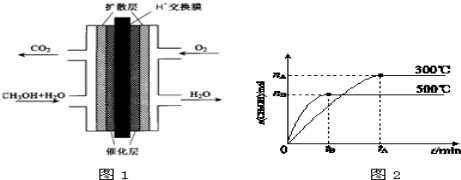
-
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
①每消耗1 mol CH4可以向外电路提供8 mol e- ②负极上CH4失去电子,电极反应式为CH4+10OH--8e-=CO+7H2O ③负极上是O2获得电子,电极反应式为O2+2H2O+4e-=4OH- ④电池放电后,溶液的pH不断升高
A.①② B.①③ C.①④ D.③④
难度: 中等查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
B.一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣38.6 kJ/mol
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol
D.HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
难度: 中等查看答案及解析
-
有下列物质:①NaOH固体:②浓硫酸;③NH4N03晶体;④CaO固体.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水血呈现如下图所示状态,判断加入的物质可能是
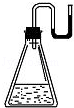
A.①②③④ B.①②④ C.②③④ D.①②③
难度: 简单查看答案及解析
-
下列化学用语的描述正确的是
A.氨水显碱性:NH3•H2O═NH4++OH﹣
B.Na2S溶液显碱性:S2﹣+2H2O
H2S+2OH﹣
C.硫酸氢钠溶液显酸性:NaHSO4═Na++H++SO42﹣
D.AlCl3溶液显酸性:Al3++3H2O
Al(OH)3↓+3H+
难度: 简单查看答案及解析
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.①③ C.③④ D.②④
难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s) ΔH>0下列叙述正确的是
A.加入少量W,逆反应速率增大
B.升高温度,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡
D.平衡后加入X,上述反应的ΔH增大
难度: 简单查看答案及解析
-
将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:
2A(g)+3B(g)
2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得:v(D)=0.25 mol/(L·min),则下列推断正确的是
A.v(C)=0.2 mol/(L·min) B.z=3
C.B的转化率为25% D.C的体积分数约为28.6%
难度: 简单查看答案及解析
-
下列说法中正确的是
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.AgCl悬浊液中存在平衡:AgCl(s)⇌Ag+(aq)+Cl﹣(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
C.硬水中含有较多的Ca2+、Mg2+、HCO3﹣、SO42﹣,加热煮沸可以完全除去其中的 Ca2+、Mg2+
D.为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀
难度: 中等查看答案及解析
-
常温下,下列溶液中与1×10-5mol/L的NaOH溶液pH相同的是
A.把pH=6的盐酸稀释1000倍
B.把pH=8的NaOH溶液稀释10倍
C.把10mL 1×10-5mol/L的H2SO4溶液与10mL 4×10-5mol/L的NaOH溶液相混合
D.把c(OH-)=10-5mol/L的NaOH溶液10mL加到100mL浓度为10-4mol/L的NaOH溶液中
难度: 中等查看答案及解析
-
下列各组离子在相应的条件下可能大量共存的是
A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D.
=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
难度: 困难查看答案及解析
-
某温度下,C和H2O(g)在密闭容器里发生下列反应:
C(s)+H2O(g)⇌CO(g)+H2(g);
CO(g)+H2O(g)⇌CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9mol•L﹣1,c(CO)=0.1mol•L﹣1.则下列叙述正确的有
A.CO在平衡时转化率为10%
B.平衡浓度c(CO2)=c(H2)
C.平衡时气体平均相对分子质量约为23.3
D.其他条件不变时,缩小体积,H2O(g)的转化率随之降低
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH﹣)>c(A﹣)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na2CO3)<c(CH3COONa)<c(NaOH)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO﹣)+2c(OH﹣)=2c(H+)+c(CH3COOH)
D.0.1mol•L﹣1的NaHA溶液,其pH=4:c(HA﹣)>c(H+)>c(H2A)>c(A2﹣)
难度: 困难查看答案及解析
-
在一定条件下,下列可逆反应达到化学平衡:I2(g)+H2(g)⇌2HI(g);△H<0,要使混合气体的颜色加深,可以采取的方法是
A.降低温度 B.增大压强 C.增大H2的浓度 D.减小压强
难度: 简单查看答案及解析
-
在恒温恒容的密闭容器中,对于反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是
A.增大O2的浓度,SO3的化学反应速率减慢
B.1molSO2与过量的O2反应,一定生成1molSO3
C.起始投入2molSO2、1molO2与起始投入2molSO3,达到平衡状态时,SO3的体积分数相等
D.往平衡体系中充入一定量的N2,使体系的压强增大,平衡正向移动
难度: 中等查看答案及解析
-
下列反应达到平衡后增大压强或降低温度,平衡都向正反应方向移动的是
A.2NO2(g)⇌N2O4(g);△H<0
B.3O2(g)⇌2O3(g);△H>0
C.H2(g)+I2(g)⇌2HI(g);△H<0
D.2NH3(g)⇌3H2(g)+N2(g);△H>0
难度: 简单查看答案及解析
-
100mL 6mol•L﹣1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量
①Na2CO3(s) ②BaCl2(aq) ③Na2S(s) ④CH3COONa(s) ⑤KNO3(aq) ⑥H2O ⑦NaCl(aq)
A.①③④⑥ B.②④⑥⑦ C.②③④⑥ D.③④⑤⑦
难度: 中等查看答案及解析
-
下列实验事实与平衡移动无关的是
A.氯气难溶于饱和食盐水
B.用加压的方法促进CO2在水中的溶解
C.FeCl3+3KSCN⇌Fe(SCN)3+KCl,向体系中加入KCl固体
D.合成氨工业中,及时将氨气液化移出
难度: 简单查看答案及解析
-
如图表示温度和压强对平衡X+Y⇌2Z的影响.下列叙述正确的是
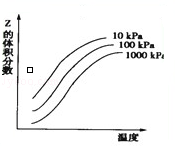
A.增大压强,平衡向右移动
B.升高温度,平衡向左移动
C.X和Y中只有一种为气态,Z为气态
D.上述反应的正反应为放热反应
难度: 中等查看答案及解析
-
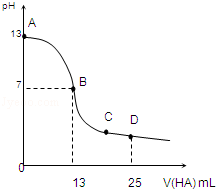
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
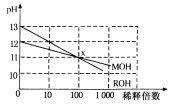
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小,下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
可逆反应:aA(g)+bB(s)
cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是
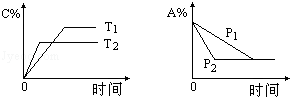
A.T1<T2 △H>0 B.T1>T2 △H<0
C.P1<P2 a=c+d D.P1<P2 a+b=c+d
难度: 中等查看答案及解析
-
某温度下纯水中c(H+)=10﹣6mol/L,此温度下pH=5的盐酸与pH=9的氢氧化钡溶液混合后pH=7,则氢氧化钡溶液与盐酸之比为
A.2:99 B. 1:1 C. 1:99 D. 1:100
难度: 中等查看答案及解析
-
室温下,现有三种酸,a盐酸、b乙酸、c硫酸的稀溶液,下列说法正确的是
A.同浓度,pH由大到小:c>a>b
B.同浓度同体积,分别与氢氧化钠中和,所需的氢氧化钠的物质的量由大到小:c>a>b
C.同pH,酸的物质的量浓度由大到小:b>a>c
D.同pH同体积,分别于少量且质量相同的Zn片反应,反应所需时间由长到短:b>a>c
难度: 中等查看答案及解析
-
已知:酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B.c(HCO3-)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+c(CO32-)
难度: 困难查看答案及解析
-
有体积相同、相等pH的烧碱溶液和氨水,下列叙述中正确的是
A.两溶液物质的量浓度相同
B.用同浓度的盐酸中和时,消耗盐酸的体积相同
C.两溶液中OH-离子浓度相同
D.加入等体积的水稀释后,pH仍相等
难度: 中等查看答案及解析
-
下列说法正确的是
A.pH=2和pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液c(Na+)与c(CO
)之比为2:1
C.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1
D.pH=1的硫酸中加入等体积0.05 mol/L的BaCl2溶液,两者恰好反应C(SO42-)=0
难度: 中等查看答案及解析
-
将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末。下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是
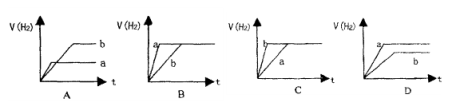
难度: 困难查看答案及解析
-
用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
难度: 中等查看答案及解析
-
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag ③实验过程中取出盐桥,原电池仍继续工作 ④将铜片侵入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
难度: 中等查看答案及解析
-
固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。
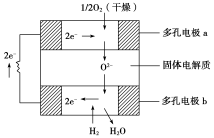
下列判断正确的是
A.有O2参加反应的a极为电池的负极
B.电路中每转移2mole-,则消耗H2的体积为22.4L.
C.a极对应的电极反应式为O2+2H2O+4e-=4OH-
D.该电池的总反应式为2H2+O2
2H2O
难度: 中等查看答案及解析