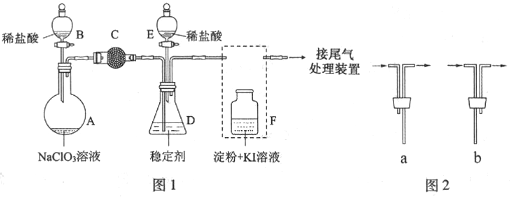
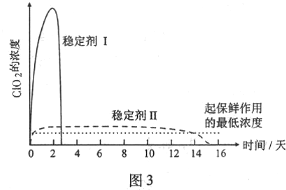
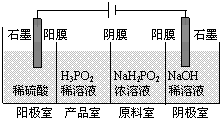
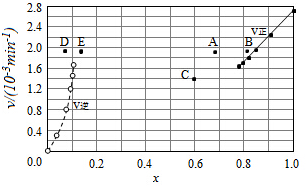
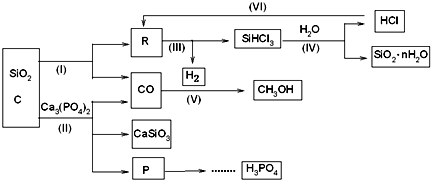
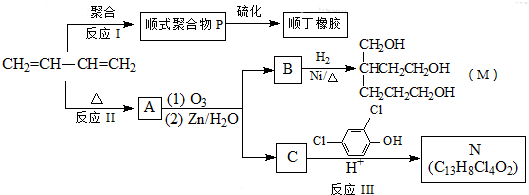
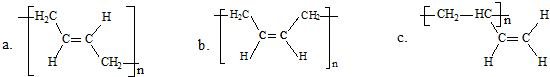
-
下列说法不正确的是( )
A.利用二氧化碳制造全降解塑料,可以减缓二氧化碳对环境的影响
B.淀粉、油脂、蛋白质都能在人体内水解,也能在体内氧化提供能量
C.CO2与SiO2都是ⅣA族元素的氧化物,但它们的物理性质特别是在熔沸点、硬度上相差很大,这是由于它们的化学键类型不同造成的
D.酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱.根据这一理论,Al(OH)3、NaHCO3都是酸碱两性物质
难度: 中等查看答案及解析
-
Wolff-Kishner-黄鸣龙反应是醛类或酮类在碱性条件下与肼作用,使得>C=O转化为-CH2-。如:
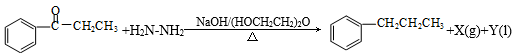 其中,X和Y不污染环境,下列说法中不正确的是( )
其中,X和Y不污染环境,下列说法中不正确的是( )A.肼作还原剂
B.X是N2
C.Y是H2O
D.
在酸性条件下水解为苯甲酸和乙醇
难度: 困难查看答案及解析
-
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
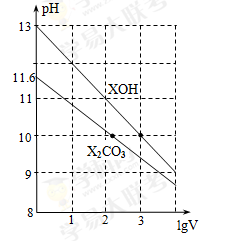
A.XOH是弱碱
B.pH=10的两种溶液中的c(X+):XOH大于X2CO3
C.已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
难度: 困难查看答案及解析
-
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法不正确的是( )
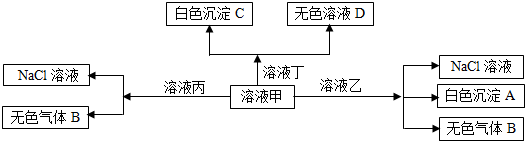
A.在甲中滴加丁可能发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O
B.溶液丙中还可以大量共存的离子有:I-、NO3-、SO42-
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
难度: 困难查看答案及解析
-
A、B、C、D、E是原子序数依次增大的五种短周期元素且B、C相邻,A元素可以与B、C、E元素分别形成甲、乙、丙三种物质且甲、乙均为10电子化合物,丙为18电子化合物.D元素的最外层电子数与核外电子层数相等.已知:甲+E2=丙+B2,甲+丙=丁,下列说法正确的是( )
A.离子半径:D>C>B
B.A与B两种元素共同形成的10电子粒子有3种
C.D元素在周期表中的位置可以是第二周期第ⅡA族
D.丁物质均由非金属元素构成,只含共价键
难度: 中等查看答案及解析
-
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
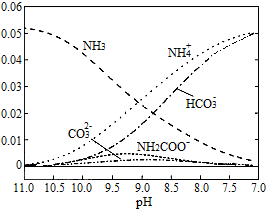
A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,
不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
难度: 困难查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
难度: 困难查看答案及解析