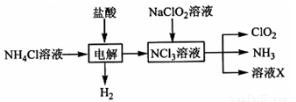
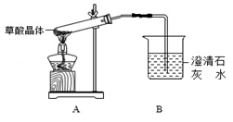
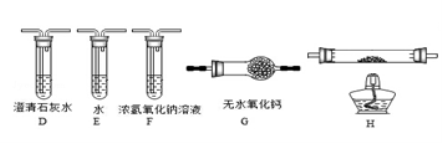
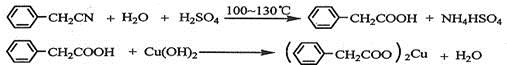-
化学与材料、生活和环境密切相关。下列有关说法中正确的是
A.新型材料聚酯纤维、光导纤维都属于有机高分子
B.酸性高锰酸钾溶液应装在酸式滴定管中,原因是酸性高锰酸钾能氧化橡胶
C.植物油和裂化汽油都能使溴水褪色,原理是不同的
D.明矾能够用于净水,是因为明矾的溶液是酸性的
难度: 简单查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选
项
实验操作
实验现象
结论
A
向某溶液中加入盐酸酸化的BaCl2溶液
生成白色沉淀
该溶液中一定含有SO42—
B
BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸
有气体生成
Ksp(BaCO3)<Ksp(BaSO4)
C
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2已经变质
D
将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水
实验现象1:上层溶液不变红,下层溶液紫红色
实验现象2:上层溶液变红
氧化性:Br2>Fe3+>I2
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol羟基中含有的电子数为0.9 NA
B.标准状况下,12g金刚石中含共价键的数目为4NA
C.0.1 mol N2与足量H2充分反应,转移的电子数为0.6 NA
D.235g核素
发生裂变反应:
净产生的中子(
)数为10NA
难度: 困难查看答案及解析
-
下列有关说法正确的是( )
A.用托盘天平准确称取0.4000 g NaCl固体可配成100 mL 0.1000 mol·L-1的NaCl标准溶液
B.有盐桥的原电池和无盐桥的原电池原理相同,因此没必要使用盐桥。
C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H>0,因此该反应不能自发进行
D.电解精炼铜时,阳极泥可用于提取贵重金属。
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.HCO3-电离的离子方程式:HCO3-+H2O
CO32-+H3O+
B.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
C.过量的CO2通入NaOH溶液中:CO2—+2OH—=CO32—+H2O
D.新制氢
氧化铜(碱性)和乙醛反应:CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
难度: 中等查看答案及解析
-
常温下,下列溶液中各组离子一定大量共存的是( )
A.使pH试纸呈红色的溶液中:Na+、AlO2—、NO3—、CO32—
B.遇苯酚溶液显紫色的溶液:Na+、SO32-、S2-、Cl-
C.含有0.1 mol·L-1 HCO的溶液:Na+、K+、NO、C6H5O-
D.水电离出的H+浓度为1.0×10-12 mol·L-1的溶液:Na+、Fe3+、SO42-、NO3—
难度: 困难查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是( )
实验目的
实验操作
A
称取2.0gNaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
配制FeCl3溶液
将FeCl3固体溶于适量盐酸并稀释到所需浓度
C
检验溶液中是否含有NH4+
取少量试液于试管中,加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
难度: 困难查看答案及解析
-
己知在碱性溶液中可发生如下反应:R(OH)3 + 2C1O- + OH- = RO4n-+2Cl- +2H2O。则RO4n-中 n是 ( )
A. 1 B. 2 C.3 D.4
难度: 困难查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
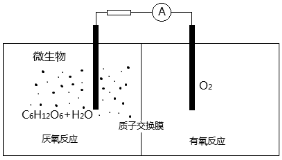
A.负极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.正极反应为:O2 + 4e- +2H
2O=4OH−
难度: 困难查看答案及解析
-
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述正确的是( )
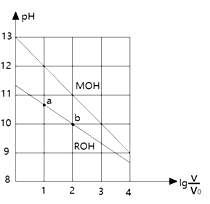
A.MOH的碱性弱于ROH的碱性
B.ROH的电离程度:b点小于a点
C.当
=2时,若两溶液同时降低温度,则c(M+)/c(R+)增大
D.两溶液无限稀释,它们的c(OH-)永远是MOH>ROH
难度: 困难查看答案及解析
-
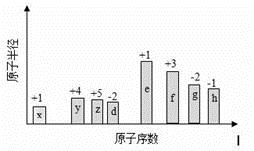
原子序数依次增大的短周期元素a、b、c、d,它们的最外层电子数分别为1、5、6、1。a-的电子层结构与氦相同,b和c的次外层电子数与电子层数相同,c2-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素b、c的离子半径大小为:c<b
B. a和b、c均能形成电子数为18的分子。
C. 元素a、b、c各自最高和最低化合价的代数和分别为0、2、4
D. d和其他3种元素均能形成离子化合物
难度: 中等查看答案及解析
-
某化合物由两种单质直接反应生成,将其加入过量明矾溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是: ( )
A、CuCl2 B、Na2O2 C、FeCl2 D、SiO2
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是( )
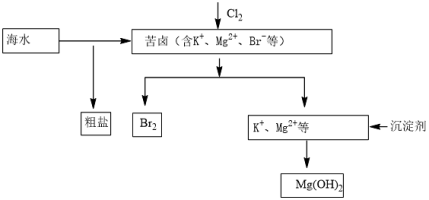
A.工业生产中常选用NaOH作为沉淀剂
B.粗盐可采用溶解、过滤和重结晶等过程进一步提纯
C.向苦卤中通入Cl2是为了提取溴
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
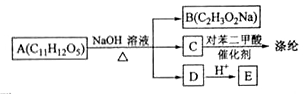
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )
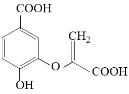
A. 分子中含有3种官能团
B.可与乙醇、乙酸、溴水发生反应,且反应类型相同
C.1mol分枝酸最多可与2molNaHCO3发生反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
合成导电高分子材料PPV的反应:
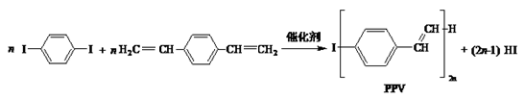
下列说法正确的是( )
A.合成PPV的反应为缩聚反应
B.PPV与聚苯乙烯具有相同的重复结构单元
C.
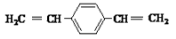 和苯乙烯互为同系物
和苯乙烯互为同系物D.通过红外光谱测定PPV的平均相对分子质量,可得其聚合度
难度: 困难查看答案及解析
-
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )
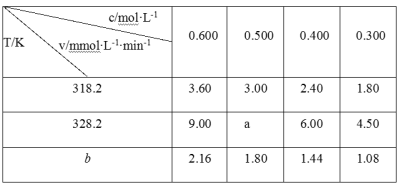
A.a=7.50
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b>318.2
D.温度为b时,蔗糖浓度减少一半所需的时间比318.2K时长
难度: 困难查看答案及解析
-
常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol·L−1,下列说法错误的是( )
A.四种溶液的pH的大小顺序:①>③>④>②
B.将溶液①、②等体积混合所得溶液呈碱性且:c(NH4+) >c(NH3·H2O)
C.向溶液①、②中分别滴加25mL 0.1mol·L−1盐酸后,溶液中c(NH4+):①<②
D.将溶液③、④等体积混合所得溶液中:2c(OH−)-2c(H+)=3c(H2CO3)+2c(HCO3-)-c(CO32−)
难度: 困难查看答案及解析
-
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min
n(SO2)/mol
n(O2)/mol
0
2
1
5
1.2
10
0.4
15
0.8
[
下列说法不正确的是( )
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1 min−1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入2.5mol SO3,达平衡时SO3的转化率小于40%
难度: 困难查看答案及解析
-
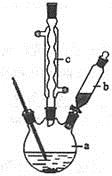
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
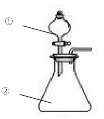
选项
①中物
质
②中物质
预测②中的现象
A.
盐酸
滴有酚酞的漂白液
红色褪去
B.
浓硝酸
用砂纸打磨过的铝条
持续产生大量红棕色气体
C.
小苏打溶液
苯酚溶液
立即产生气泡
D.
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
难度: 困难查看答案及解析
-
现有mA (s) + nB (g)
pC (g)(正反应放热)的可逆反应,在一定温度下平衡时B的体积分数和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )

A.m+n<p
B.n<p
C.x点的混合物中v正>v逆
D.x点比y点的混合物正反应速度大
难度: 困难查看答案及解析