-
中国传统文化对人类文明贡献巨大。下列各文献中所记载的古代化学研究过程或成果不涉及分离提纯操作的是( )
A. 《本草纲目》“(烧酒) 自元时创始,其法用浓酒和糟入甑,蒸令气上,用器盛露滴。”
B. 《齐民要术》“凡酿酒失所味者,或初好后动未压者,皆宜廻作醋。”
C. 《开宝本草》“(消石) 所在山泽,冬月地上有霜扫取,以水淋汁,后乃煎炼而成。”
D. 《天工开物》“草木之实,其中蕴藏膏液,而不能自流,假媒水火,凭藉木石,而后倾注而出焉。”
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L二氯甲烷的分子数约为NA个
B. 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA
C. 17.6 g丙烷中所含的共价键为4NA个
D. 将标况下11.2L的Cl2通入水中转移的电子数目为0.5NA
难度: 困难查看答案及解析
-
通过实验、观察、类比、推理等方法得出正确的结论是化学研究的方法之一。下列反应的推断或解释正确的是( )
选项
操作
实验现象
推断或解释
A
燃烧的钠粒放入CO2中
燃烧且有白色和黑色颗粒产生
黑色颗粒是炭,白色颗粒可能是Na2CO3
B
NH3通入到AgNO3溶液中
先有沉淀后消失
AgOH 具有两性
C
乙醇蒸气通过灼热的Fe2O3 固体
红色固体变黑色,且有刺激性气味
乙醇还原Fe2O3一定生成Fe 和乙醛
D
灼热的木炭放入浓硝酸中
放出红棕色气体
一定是木炭与浓硝酸反应生 成 NO2 呈红棕色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(
),杏仁含苯甲醛(
)。下列说法错误的是
A. 肉桂醛能发生加成反应、取代反应和加聚反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛的芳香族同分异构体中能发生银镜反应的有3种
D. 苯甲醛分子中所有原子可能位于同一平面内
难度: 困难查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W原子的最外层电子数是电子层数的2倍,Y原子次外层电子数与其他各层电子总数相等,W和X的原子序数之和等于Z的原子序数。下列说法正确的是
A. 含氧酸的酸性:Z>W
B. 简单离子半径:X>Y>Z
C. 四种元素均能与氢元素形成共价键
D. 在一定条件下W的单质能与Y的最高价氧化物对应的水化物反应
难度: 困难查看答案及解析
-
NaBH4燃料电池具有理论电压高、能量密度大等优点。已知,能量密度=电池输出电能/燃料质量,以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
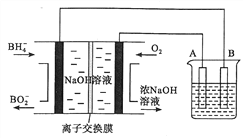
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=B
+6H2O
C. 若NaBH4 燃料电池的电压为U伏,则此电池的能量密度为2.03×104UkJ·kg-1
D. 每消耗2.24 L O2(标准状况)时,A电极的质量减轻12.8 g
难度: 困难查看答案及解析
-
T ℃,分别向10 mL浓度均为1 mol·L-1的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。已知:pKa=-lgKa,下列叙述正确的是
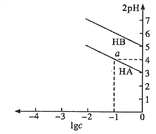
A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA)=0.1 mol·L-1,pH=4
C. 弱酸HB的pKa≈5
D. 酸性:HA<HB
难度: 困难查看答案及解析
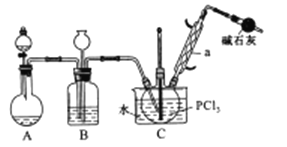
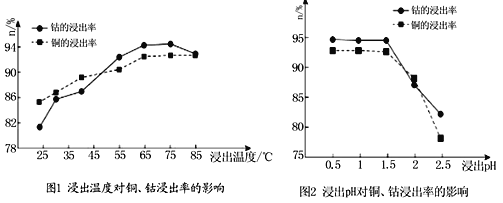
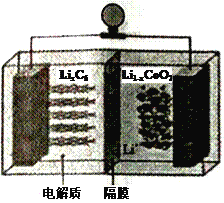
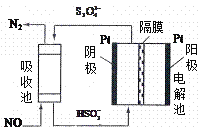 。
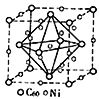
。
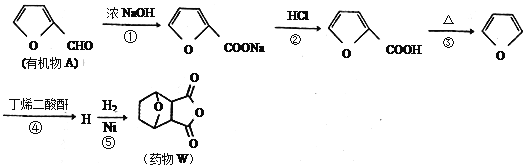
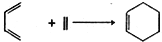 (Diels-Aider反应)
(Diels-Aider反应)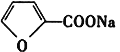 外,还生成另一产物,此产物的结构简式为__________________。
外,还生成另一产物,此产物的结构简式为__________________。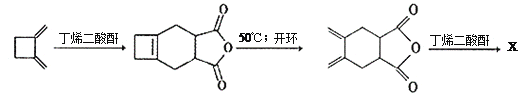
 制备丁烯二酸酐
制备丁烯二酸酐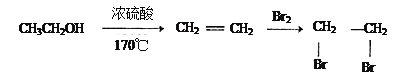 。
。