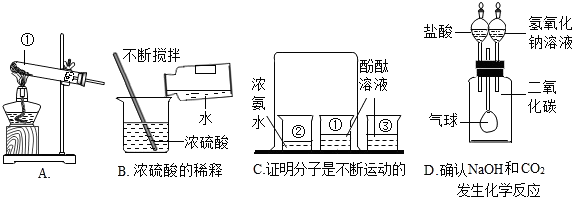
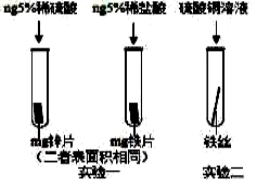
-
汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是
A.氧气 B.氮气 C.稀有气体 D.二氧化碳
难度: 简单查看答案及解析
-
诗词是民族灿烂文化的瑰宝.下列著名诗句中只含有物理变化的是
A.野火烧不尽,春风吹又生 B.粉身碎骨浑不怕,要留清白在人间
C.夜来风雨声,花落知多少 D.春蚕到死丝方尽,蜡炬成灰泪始干
难度: 简单查看答案及解析
-
黔北地下水的硬度较大。日常生活中为了降低水的硬度,常采用的方法是
A.加肥皂水 B.煮沸 C.蒸馏 D.过滤
难度: 简单查看答案及解析
-
下面是家庭中常用的洗涤剂及其pH,其中显酸性的是
A.厕所清洁剂(pH=1) B.洗发精(pH=8)
C.洗衣液(pH=10) D.厨房清洁剂(pH=13)
难度: 简单查看答案及解析
-
二氧化碳的下列用途只利用了其物理性质的是
A.CO2用作光合作用的原料 B.CO2用于灭火
C.干冰用于人工降雨 D.二氧化碳能用来生产汽水等碳酸饮料
难度: 简单查看答案及解析
-
2015年10月,中国女药学家屠呦呦因创制新型抗疟药——青蒿素和双氢青蒿素的贡献,与另外两位科学家共享2015年度诺贝尔生理学或医学奖。青蒿素的化学式为C15H22O5。下列说法中不正确的是
A.青蒿素由碳、氢、氧三种元素组成
B.一个青蒿素分子由15个碳原子、22个氢原子和5个氧原子构成
C.青蒿素分子中碳、氢、氧元素的原子个数比为15:22:5
D.青蒿素中氢元素的质量分数最大
难度: 简单查看答案及解析
-
对于图示
 ,理解错误的是
,理解错误的是A.原子可结合成分子
B.可用
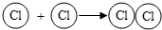 表示氯分子的形成过程
表示氯分子的形成过程C.物质都是由分子构成
D.化学变化是分子的裂解和原子的重新组合
难度: 简单查看答案及解析
-
进行定量化学实验时离不开数据的测定,下列实验数据合理的是:①用托盘天平称取15.6gNaCl固体;②用100mL量筒量取18mL某溶液;③用普通温度计测得某液体温度为25.62℃;④用10mL量筒量取6.6mL某溶液。
A.①② B.②③ C.③④ D.①④
难度: 简单查看答案及解析
-
对反应:X+H2SO4=BaSO4↓+2Y,下面分析正确的是
A.Y中可能含有氢元素 B.Y可能是HCl
C.X一定是BaCl2 D.X和Y的相对分子质量之差一定为l35
难度: 简单查看答案及解析
-
向一定量稀硫酸中加入一定量铜粉,无气泡冒出;用导管向稀硫酸中通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色.测得溶液质量与实验时间的关系如图.下列说法错误的是

A.ab段说明Cu不能转换出硫酸中的氢
B.从b点到c点,溶液的pH逐渐增大
C.从c点到d点,溶液中的溶质只可能有一种
D.bc段溶液中有硫酸铜生成
难度: 中等查看答案及解析