-
下列说法正确的是
A.燃料电池由外设装备提供燃料和氧化剂
B.Mg和Al通常用热还原的方法来冶炼
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.蛋白质、棉花、淀粉、油脂都是由高分子组成的物质
难度: 中等查看答案及解析
-
关于某有机物
的性质叙述正确的是
A.1 mol该有机物可以与3 mol Na发生反应
B.1 mol该有机物可以与3 mol NaOH发生反应
C.1 mol该有机物可以与6 mol H2发生加成反应
D.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
难度: 中等查看答案及解析
-
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是
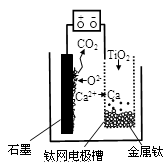
A.将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的
B.阳极的电极反应式为:C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
难度: 中等查看答案及解析
-
下列说法正确的是
A.水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的比值增大
D.室温下,CH3COOH的
,NH3·H2O的
,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等
难度: 中等查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结论
A
向盛有Fe(NO3)2溶液的试管
中加入0.1mol/L H2SO4溶液
试管口出现红棕色
气体
溶液中NO3—被
Fe2+还原为NO2
B
向饱和Na2CO3溶液中通入足
量CO2
溶液变浑浊
析出Na2CO3晶体
C
等体积pH=2的HX和HY两
种酸分别与足量的铁反应,排
水法收集气体
HX放出的氢气多且
反应速率快
HX酸性比HY弱
D
先向2mL0.1mol/LNa2S溶液中
滴几滴0.1mol/LZnSO4溶液,再
加入几滴0.1mol/LCuSO4溶液
开始有白色沉淀生成;后又有黑色沉淀生成
Ksp(ZnS)<Ksp(CuS)
难度: 中等查看答案及解析
-
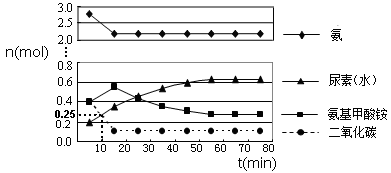
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
t/s
0
5
15
25
35
m (A)/mol
1.0
0.85
0.81
0.80
0.80
A.反应在前5 s的平均速率v(A)=0.17mol∙L-1∙s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol∙L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前V(正)<V(逆)
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,下列说法一定正确的是:
A.原子最外层电子数: Z>Y>X B.单质沸点:X>Y>Z
C.离子半径:X2->Z-> Y+ D.原子序数:X>Z>Y
难度: 中等查看答案及解析