-
化学与能源开发、环境保护、资源利用等密切相关,下列说法正确的是
A.硅酸钠的水溶液俗称水玻璃,可用作木材防火剂
B.开发核能、太阳能等新能源,推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
难度: 中等查看答案及解析
-
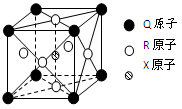
下列分类或归类正确的是:
①铝热剂、纯净矿泉水、冰水混合物均为混合物 ②NaOH、HD、IBr均为化合物
③明矾、烧碱、硫酸均为强电解质 ④C60、金刚石、石墨均为碳的同素异形体
⑤碘酒、淀粉溶液、水雾、纳米材料均为胶体
A.①②③⑤ B.③④⑤ C.②④⑤ D.③④
难度: 中等查看答案及解析
-
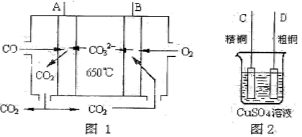
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是

A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
难度: 简单查看答案及解析
-
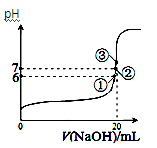
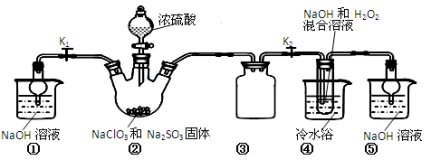
下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是

难度: 中等查看答案及解析
-
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)
4C (s)+D(g),△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。

下列说法正确的是
A.平衡时B的转化率为50%
B.若再加入B,则再次达到平衡时正、逆反应速率均增大
C.若保持压强一定,再加入B,则反应体系气体密度减小
D.若保持压强一定,当温度升高10℃后,则图中θ>45º
难度: 中等查看答案及解析
-
下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图。
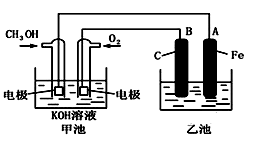
下列说法中不正确的是
A.甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
B.若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e- = 2H2O+O2↑
C.若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
D.常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:CH3OH(l)+1.5O2(g)==CO2(g)+2H2O(l) ΔH= -725.80 kJ·mol-1
难度: 困难查看答案及解析
-
下列说法正确的是
A.0.01mol/L的Na2HPO4溶液中存在如下的平衡:HPO42-
H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小
B.饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-)
C.常温下,0.01mol/L的 HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混和后,所得溶液的pH≤7
D.在NH4HSO3 与NH4Cl混合溶液中,c(NH4+)= c(SO32-)+ c(HSO3-)+ c(H2SO3)+ c(Cl-)
难度: 困难查看答案及解析