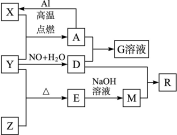
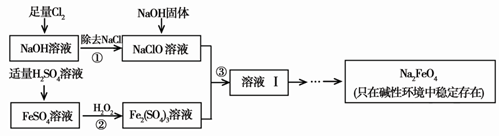
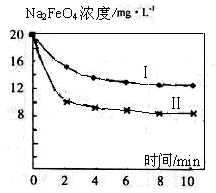
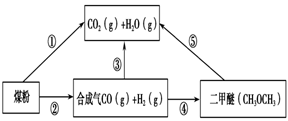
-
下列物质中,含有非极性共价键的是
A.H2 B.H2O C.NaCl D.NaOH
难度: 中等查看答案及解析
-
下列各物质中,不能发生水解反应的是
A.葡萄糖 B.纤维素 C.油脂 D.蛋白质
难度: 简单查看答案及解析
-
有一碘水和Fe(OH)3胶体的颜色极为相似。不用化学方法将它们区别开来,这样的方法有
①布朗运动;②丁达尔现象;③加热法;④电泳实验法;⑤加电解质法
A.①③⑤ B.①②④⑤ C.②③④⑤ D.全部
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列叙述正确的是
A.10 g H218O含有的中子数为5NA
B.1 mol羟基(-OH)含有的电子数为10NA
C.1 mol 氯气参加反应时,电子转移数目一定为2NA
D.标准状况下,11.2L己烷含有的分子数为0.5 NA
难度: 中等查看答案及解析
-
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
A.半导体材料砷化镓 B.透明陶瓷材料硒化锌
C.吸氢材料镧镍合金 D.超导材料K3C60
难度: 中等查看答案及解析
-
某乙醇水溶液的质量分数为w%,物质的量浓度为cmol/L,密度为dg/mL,1Kg这种溶液中含有的乙醇是:
A.46C B.c/d mol C.c mol D.1000dw g
难度: 中等查看答案及解析
-
下列离子组能大量共存的是
A.含大量Al3+的溶液中:K+、Na+、NO3-、S2-
B.含大量AlO2-的溶液中:Na+、K+、NO3-、H+
C.含大量H+的溶液中:I-、Cl-、NO3-、Na+
D.含大量OH-的溶液中:CO32-、Cl-、F-、K+
难度: 中等查看答案及解析
-
同位素在化学反应机理的研究中有着重要的作用。下列乙酸乙酯水解的化学方程式不正确的是
A.CH3COOCH2CH3+HOD →CH3COOD+CH3CH2OH
B.CH3COOCH2CH3+HOD →CH3COOH+CH3CH2OD
C.CH3CO18OCH2CH3+H2O →CH3CO18OH+CH3CH2OH
D.CH3C18OOCH2CH3+H2O →CH3C18OOH+CH3CH2OH
难度: 简单查看答案及解析
-
下列实验或生产操作,其中没有新物质生成的是
①蛋白质溶液中加入硫酸铵后形成沉淀
②碘化银用于人工降雨
③二氧化氮经加压凝成无色液体
④溴水滴入植物油中振荡褪色
⑤水泥、砂子和水混合后硬化
⑥除去混在氢氧化铁胶体中的氯化铁
A.①②③ B.②④⑥ C.③⑤ D.①⑥
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是。
A.离子半径 W2+>X+ B.离子的还原性Y2->Z-
C.氢化物的稳定性 H2Y>HZ D.原子半径 X < W
难度: 中等查看答案及解析
-
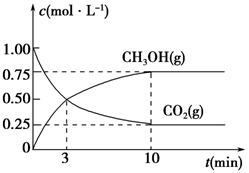
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,得b克固体
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
D.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
难度: 中等查看答案及解析
-
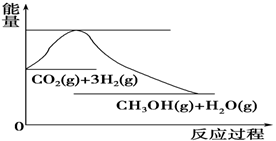
下列依据热化学方程式得出的结论正确的是
A.已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
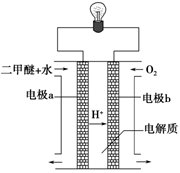
下图装置可用于
A.用氯酸钾和少量二氧化锰,制取氧气
B.用NH4Cl与Ca(OH)2,制取NH3
C.用Cu和浓HNO3反应制取NO2
D.用Cu和稀HNO3反应制NO
难度: 中等查看答案及解析
-
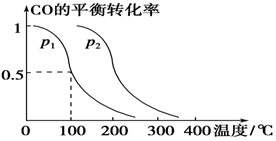
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列研究目的和示意图相符的是
A B C D
研究目的 压强对反应的影响(p2>p1) 温度对反应的影响 平衡体系中增加N2的浓度对反应的影响 催化剂对反应的影响
示意图

难度: 困难查看答案及解析