-
将一定质量的镁、铜合金加入到稀硝酸中,合金完全溶解,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述正确的是
A.反应中转移电子的总数为0.3mol
B.反应过程中,消耗硝酸的物质的量为0.3mol
C.沉淀完全时消耗NaOH溶液的体积为100mL
D.开始加入合金的质量可能为3.4g
难度: 困难查看答案及解析
-
下列物质的分类组合正确的是
A
B
C
D
纯净物
纯硫酸
冰醋酸
水玻璃
胆矾
混合物
水煤气
福尔马林
冰水混合物
漂白粉
弱电解质
氨水
氟化氢
氨
水
非电解质
干冰
乙醇
三氧化硫
氯气
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO-
B.0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I-
C.0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42-
D.由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、Ba2+、NO3-、Cl-
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.23gNa与足量H2O反应完全后失去2NA个电子
B.1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4LN2和H2混合气中含2NA个原子
D.3mol单质Fe完全转变为Fe3O4,失去9NA个电子
难度: 困难查看答案及解析
-
下列物质在生活中应用时,起还原作用的是
A.三氯化铁作净水剂 B.硅胶作干燥剂
C.漂粉精作消毒剂 D.铁粉作食品袋内的脱氧剂
难度: 简单查看答案及解析
-
进行化学实验时应强化安全意识。下列做法正确的是
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.蒸馏时应先向冷凝管中通入冷凝水再加热
难度: 中等查看答案及解析
-
下列有关实验操作、现象和结论都正确的是
选项
实验操作
现象
结论
A
溶液中加入盐酸,再滴加BaCl2溶液
先无现象,后产生白色沉淀
原溶液中有SO42-
B
向两份蛋白质溶液中分别滴加饱和Na2SO4溶液和CuSO4溶液
均有固体析出
蛋白质均发生变性
C
将Mg、Al与NaOH溶液组成原电池
Mg电极溶解
Mg比Al金属活动性强
D
向稀HNO3溶液中加入过量铁粉充分反应后,滴入KSCN溶液
溶液变为血红色
稀HNO3具有氧化性,能将Fe氧化成Fe3+
难度: 困难查看答案及解析
-
氟化氮是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2molHNO3,则转移0.2mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 困难查看答案及解析
-
下列叙述正确的是
A.乙醇能够使酸性KMnO4溶液和酸性K2Cr2O7溶液褪色均被氧化成乙酸
B.向酸性高锰酸钾中加入草酸溶液,随着反应的进行,反应速率逐渐减小
C.向某溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该溶液中存在SO42-或SO32-
D.实验室提纯混有少里氯化钠的硝酸钾,通常采用重结晶的方法
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.13.8gNO2与足量水反应,转移电子数为0.2NA
B.标准状况下,22.4L溴苯中含有氢原子数为5NA
C.500mL 2 mol/LNH4NO3溶液中,含有NH4+数为NA
D.用惰性电极电解足量CuSO4溶液,生成22.4L气体时转移电子数为4NA
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得出的结论错误的是
选项
操作
现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状碳
浓硫酸具有脱水性和强氧化性
B
向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去
2min后,试管里出现凝胶
非金属性:Cl>Si
C
向盛有铜片的容器中加入浓硝酸
产生大量红棕色气体,溶液变为蓝绿色
浓硝酸具有强氧化性和酸性
D
向等浓度的KCl、KI混合液中滴加AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
难度: 困难查看答案及解析
-
利用表中提供的仪器和药品,能达到相应实验目的的是
选项
仪器
药品
实验目的
A
烧杯、玻璃棒、胶体滴管
FeCl3溶液、NaOH溶液
制Fe(OH)3胶体
B
圆底烧瓶、导气管、烧杯、铁架台
干燥的二氧化碳气体、蒸馏水
模拟喷泉实验
C
酸式滴定管、锥形瓶、铁架台(带铁夹)
已知浓度的盐酸、待测NaOH溶液
测定NaOH溶液的物质的量浓度
D
酒精灯、玻璃棒、蒸发皿、三脚架
NaCl溶液
蒸发溶液得到晶体
难度: 困难查看答案及解析
-
下列除杂方案错误的是
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
C2H5OH(l)
H2O(l)
新制的生石灰
蒸馏
B
NH4Cl(aq)
Fe3+(aq)
NaOH溶液
过滤
C
Cl2(g)
HCl(g)
饱和食盐水、浓H2SO4
洗气
D
NaCl(s)
Na2CO3(s)
盐酸
蒸发 结晶
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大最共存的是
A.水电离的c(H+)=1×10-3mol/L的溶液中:K+、Na+、SiO32-、SO42-
B.能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl-
C.
的溶液中:Ba2+、ClO-、Cl-、NO3-
D.能与Al 反应放出H2的溶液中:Fe2+、K+、SO42-、Cl-
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式为
A.向FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br-
B.将Na2O2放入H2O中:2Na2O2+2H2O==4Na++4OH-+H2↑
C.向NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-==BaSO4↓+H2O
D.将稀盐酸与84消毒液混合:C1-+C1O-+2H+=C12+H2O
难度: 困难查看答案及解析
-
室温下,下列各组离子在指定溶液中一定不能大量共存的是
A.在澄清透明的溶液中:H+、Na+、SO42-、Cu2+
B.在Kw/c(OH-)=1 mol·L-1的溶液中:Na+、NH4+、I-、SO42-
C.在0.1 mol·L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3-
D.在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1-
难度: 困难查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A.澄清透明的无色溶液中:Na+、K+、MnO4-、[Al(OH)4]-
B.水电离出的[H+]=10-14mol/L溶液中:Fe2+、Mg2+、NO3-、Cl-
C.加入铝能产生H2的溶液中:K+、NH4+、I-、NO3-
D.常温下c(OH-)=10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、K+
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是
A.Fe3O4与稀硝酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑
D.向FeCl3溶液中加入少量KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓
难度: 中等查看答案及解析
-
将铜和氧化铁的混和物溶于足量稀盐酸中,向所得溶液中滴入2滴KSCN溶液后出现红色。下列有关说法错误的是
A.容器中可能有固体残渣 B.所得溶液中一定存在Fe2+
C.反应过程中水的电离程度增大 D.再加入铜后,溶液红色逐渐退去
难度: 中等查看答案及解析
-
下列现象或事实不能用同一原理解释的是
A.加热碳酸氢铵晶体和氯化铵晶体都产生气体
B.漂白粉和双氧水都可用于漂白织物
C.臭氧和硫酸亚铁都可用于处理生活用水
D.向牛奶和豆浆中加入食醋都会出现絮凝物
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后容器中物质含有的N—H键数为3NA
B.标准状况下,2.24 L SO3含有的原子数为0.4 NA
C.71 g氯气与足量铁反应过程中转移的电子数为2NA
D.电解饱和食盐水时,当阴极产生22.4 L H2时,电路中转移的电子数为2NA
难度: 中等查看答案及解析
-
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
A.肯定有SO2和NO或NO2中的至少一种 B.肯定只有NO
C.可能有Cl2和O2 D.肯定没有Cl2、O2和NO2
难度: 困难查看答案及解析
-
下列叙述I和II均正确并有因果关系的是
选项
叙述I
叙述II
A
用酸度计测定SO2和CO2饱和溶液的pH,前者pH小
结论:说明H2SO3酸性强于H2CO3
B
SiO2是酸性氧化物
SiO2不与任何酸溶液反应
C
配制SnCl2溶液时,先将SnCl2溶于适量的稀盐酸中,再用蒸馏水稀释,保存时再在试剂瓶中加入少量的锡粒
抑制Sn2+水解,并防止Sn2+被氧化为Sn4+
D
浓硝酸具有强氧化性
应保存在棕色玻璃试剂瓶中
难度: 中等查看答案及解析
-
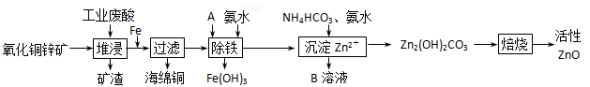
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是

A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述中正确的是
A.CH4与P4的分子结构都是正四面体形,因此在NA个CH4分子或P4分子中都含有4NA个共价键
B.在含NA个硅原子的二氧化硅晶体中含有4NA个Si-O键
C.5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去0.2NA个电子
D.NA个Fe3+完全水解可以得到NA个氢氧化铁胶体粒子
难度: 困难查看答案及解析
-
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是
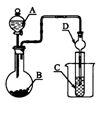
A.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
B.若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序列
参加反应的物质
生成物
①
MnO4-……
Cl2、Mn2+……
②
Cl2 、FeBr2
FeCl3、FeBr3
③
KMnO4、H2O2、H2SO4
K2SO4 、MnSO4……
A.第①组反应中生成0.5mol Cl2,转移电子1mol
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应的其余产物为H2O和 O2
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
难度: 困难查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大,A原子在元素周期表中原子半径最小,B原子最外层电子数是电子层数的3倍,D与B属于同一主族,CA2是一种储氢材料。下列叙述正确的是
A. 元素B的单质与化合物A2D反应能生成D的单质
B. 工业上利用铝热反应可制得单质C
C. 原子B、C、D半径的大小顺序:D>C>B
D. 一定条件下,过量的B单质与D单质直接生成BD3
难度: 中等查看答案及解析
-
2015年11月29日至30日,国家主席习近平出席了气候变化巴黎大会,各国就如何应对气候变化、提升经济绿色水平,实现人类可持续发展进行商讨。为达成“同呼吸,共奋斗”全国各地为治理雾霾广泛开展了一系列活动。下列活动不符合这一主题的是
A.机动车实行限行措施是减少雾霾的途径之一
B.积极推广风能、太阳能、氢能等新型能源的使用
C.通过吸收空气中CO2并利用廉价能源合成汽油可推广“绿色自由”计划
D.将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法
难度: 简单查看答案及解析