-
下列说法正确的是( )
A.需要加热方能发生的反应一定是吸热反应
B.若反应为放热反应,则该反应不必加热就可发生
C.放热反应比吸热反应容易发生
D.化学反应总是伴随着能量的变化
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是:2H2(g)+O2(g)===2H2O(l) ΔH=-483.6 kJ
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 简单查看答案及解析
-
已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则关于方程式2H2O(l)===2H2(g)+O2(g)的ΔH的说法中正确的是( )
A.方程式中的化学计量数表示分子数
B.该反应ΔH大于零
C.该反应ΔH=-571.6 kJ/mol
D.该反应可表示36 g水分解时的热效应
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
难度: 简单查看答案及解析
-
下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=+1 367.0 kJ·mol-1(反应热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(反应热)
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
难度: 简单查看答案及解析
-
已知下列热化学方程式:
Zn(s)+
O2(g)===ZnO(s) ΔH1=-351.1 kJ/mol Hg(l)+
O2(g)===HgO(s) ΔH2=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8 kJ/mol B.-254.6 kJ/mol C.-438.9 kJ/mol D.-260.4 kJ/mol
难度: 中等查看答案及解析
-
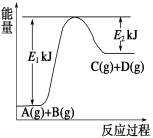
由下图分析,有关叙述正确的是( )

A.A―→B+C和B+C―→A两个反应吸收或放出的能量不等
B.A―→B+C是放热反应
C.A具有的能量高于B和C具有的能量总和
D.A―→B+C是吸热反应,则B+C―→A必然是放热反应
难度: 中等查看答案及解析
-
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为 ( )
A.2A+3B===2C B.A+3B===2C C.3A+B===2C D.A+B===C
难度: 中等查看答案及解析
-
已知4NH3+5O2
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.
v(NH3)=v(O2) B.
v(O2)=v(H2O) C.
v(NH3)=v(H2O) D.
v(O2)=v(NO)
难度: 简单查看答案及解析
-
一定温度下,对可逆反应A(g)+2B(g)
3C(g)的叙述中,能说明反应已达到平衡的是( )
A.C生成的速率与C分解的速率相等
B.单位时间内消耗a mol A,同时生成3a mol C
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
难度: 中等查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均反应速率为v=
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应: 2SO2(g)+O2(g)
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
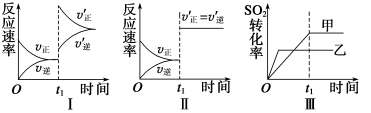
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
难度: 困难查看答案及解析
-
工业制硫酸中的一步重要反应是SO2在400~500 ℃下的催化氧化:2SO2+O2
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%地转化为SO3
C.为了提高SO2的转化率,应适当提高O2的浓度
D.达到平衡时,SO2的浓度与SO3的浓度相等
难度: 中等查看答案及解析
-
对已经达到化学平衡的下列反应: 2X(g)+Y(g)
2Z(g),减小压强时 ( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50 mol·L-1,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol·L-1。下列有关判断正确的是( )
A.x+y<z B.平衡向正反应方向移动 C.B的转化率增大 D.C的体积分数下降
难度: 中等查看答案及解析
-
已知4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是一个可逆反应。若反应物起始物质的量相同,则下图中关于该反应不正确的是 ( )


难度: 困难查看答案及解析
-
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)
PCl5(g)。达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是 ( )
A.0.40 mol B.0.20 mol
C.小于0.20 mol D.大于0.20 mol,小于0.40 mol
难度: 中等查看答案及解析