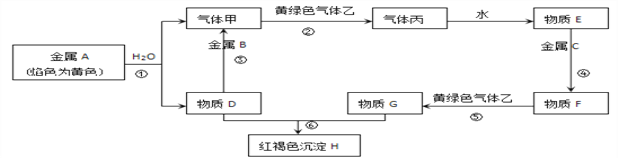
-
下列说法正确的是
A. 浓硝酸应保存于无色试剂瓶中
B. 碘是人体必需的微量元素,所以要多吃富含I2的食物
C. 二氧化硫可广泛用于食品的增白
D. 次氯酸钠溶液可用于环境的消毒杀菌
难度: 简单查看答案及解析
-
下列有关离子检验的方法正确的是
A.NH4+:加NaOH溶液,加热,滴入酚酞溶液检验所得溶液
B.CO32-:加入稀盐酸,产生无色能使澄清石灰水变浑浊的气体
C.Fe3+:加入KSCN溶液,溶液呈血红色
D.Cl-:加入AgNO3溶液,产生白色沉淀
难度: 中等查看答案及解析
-
除去混在Na2CO3粉末中的少量NaHCO3,下列最合理的方法是
A.加入适量NaOH溶液 B.加热到固体质量不变
C.加入适量HCl溶液 D.加入适量CaCl2溶液
难度: 中等查看答案及解析
-
A. 将NaOH固体直接放在托盘天平的托盘上称量
B. 将NaOH固体加水溶解,待所得溶液冷却到室温后,再转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
难度: 中等查看答案及解析
-
2013年12月6日,上海遭遇重度雾霾,空气质量指数达六级重度污染。雾霾是雾和霾的混合物,其中雾是自然天气现象,霾的核心物质是悬浮在空气中的烟、灰尘等物质,其中霾属于悬浊液,雾所属的分散系是( )
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
难度: 简单查看答案及解析
-
若不小心误将水加入你家里的食用花生油里,你将采用下列何种方法分离
A.过滤 B.分液 C.渗析 D.萃取
难度: 简单查看答案及解析
-
下列做法不能体现低碳生活的是
A. 减少食物加工过程 B. 注意节约用电
C. 尽量购买本地的、当季的食物 D. 大量使用薪柴为燃料
难度: 简单查看答案及解析
-
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应类型属于阴影部分的是( )
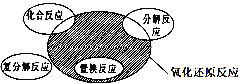
A. 2Na2O2+2H2O=4NaOH+O2↑ B. NH4HCO3
NH3↑+CO2↑+H2O
C. 4Fe(OH)2+O2+2H2O=4Fe(OH)3 D. Br2+2KI=I2+2KBr
难度: 简单查看答案及解析
-
下列气体中,不能用排水法收集的是
A.NO2 B.NO C.O2 D.H2
难度: 中等查看答案及解析
-
下列有关钠的叙述正确的是
A.钠在空气中燃烧生成氧化钠
B.钠元素在自然界中可以以游离态形式存在
C.少量金属钠可以保存在煤油中
D.金属钠投入硫酸铜溶液中有铜生成
难度: 中等查看答案及解析
-
1 mol•L-1 NaCl溶液的含义是
A.1 L水中含有1 mol NaCl B.溶液中含有1 mol NaCl
C.1 L溶液中含有58.5 g NaCl D.将58.5 g NaCl溶于1 L水中所得的溶液
难度: 中等查看答案及解析
-
需要加入适当的氧化剂才能实现的反应是( )
A. MnO2 → Mn2+ B. SO2 → SO32-
C. Cl2 → HCl D. PCl3 → PCl5
难度: 简单查看答案及解析
-
下列叙述正确的是
A.标准状况下,l mol任何物质的体积均为22.4 L
B.CH4的摩尔质量为16 g
C.1mol H2O的质量为18 g•mol-1
D.3.01×l023个SO2分子的质量为32 g
难度: 中等查看答案及解析
-
用等体积的0.1 mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的
完全沉淀,则三种硫酸盐的物质的量浓度之比为
A. 3∶2∶3 B. 3∶1∶2
C. 2∶6∶3 D. 1∶1∶1
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.盐酸与碳酸钡反应:CO32-+2H+=CO2↑+H2O
B.往硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-= BaSO4↓+Cu(OH)2↓
C.稀硫酸溶液与氨水反应:H++OH-=H2O
D.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
难度: 中等查看答案及解析
-
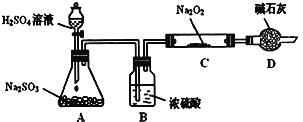
如图所示,A处通入氯气,关闭弹簧夹B时,C处红色布条无明显的变化,打开弹簧夹B时,C处红色布条逐渐褪色。由此作出的判断正确的是( )
A. D中不可能是浓硫酸
B. D中可以是水
C. 通入的氯气中含有水蒸气
D. D中可以是饱和食盐水
难度: 中等查看答案及解析
-
在无色的强酸性溶液中能大量共存的是
A.Mg2+、Na+、Cl-、SO42- B.K+、 Na+、 Cl-、 Cu2+
C.K+ 、Na+、NO3-、CO32- D.Na+、Ba2+、OH-、SO42-
难度: 中等查看答案及解析
-
将Na2O2投入FeCl3溶液中,对观察到的现象描述准确的是
A.生成白色沉淀 B.生成红褐色沉淀
C.有气泡产生 D.生成红褐色沉淀、有气泡产生
难度: 中等查看答案及解析
-
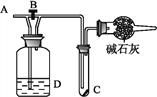
如图利用培养皿探究氨气的性质,实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象的描述及所做的解释均正确的是

选项
实 验 现 象
解 释
A
浓盐酸附近产生白烟
NH3与HCl反应生成了NH4Cl固体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化铜溶液变白色浑浊
白色浑浊的成分是Cu(OH)2
D
湿润的红色石蕊试纸变蓝
NH3是一种可溶性碱
难度: 中等查看答案及解析