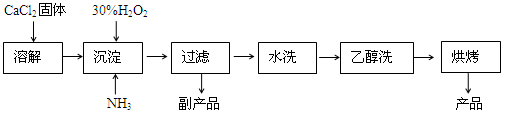
-
下列说法正确的是
A.SO2、SiO2、NO2均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.“玉兔”月球车太阳能电池帆板的材料是二氧化硅
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-)
难度: 简单查看答案及解析
-
下列关于有机物的叙述,正确的是
A.石油的分馏和煤的气化都是发生了化学变化
B.苯、溴水、铁粉混合可制成溴苯
C.苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应
D.纤维素、油脂和蛋白质在一定条件下都能水解
难度: 简单查看答案及解析
-
菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法中正确的是
A.在该反应中维生素C作催化剂
B.因为河虾中含有砷元素,所以不能食用
C.砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷可能是+3价砷
D.上述反应中维生素C作氧化剂
难度: 中等查看答案及解析
-
在短周期中,R原子最外层电子数是其次外层电子数的3倍,下列说法不正确的是
A.原子半径大小:X>Y>Z
B.氢化物的稳定性:X>Y
C.化合物YR2能使品红溶液褪色
D.X、Y、Z三种元素最高价氧化物的水化物的酸性最强的是Z
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,1.8 g H2O所含有的质子数为
B.1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为
C.25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2
D.标准状况下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.2
难度: 中等查看答案及解析
-
下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Mg2+、Na+、SO42-、Cl—
B.K+、CO32-、Cl—、NO3—
C.NH4+、Na+、SO42-、NO3—
D.Na+、K+、NO3—、SO32—
难度: 中等查看答案及解析
-
下列实验操作能达到预期实验目的的是
实验目的
实验操作
A
鉴别CO32-和 SO42-
分别加入饱和CaCl2溶液
B
比较Al和Fe的金属活动性
分别加入浓NaOH溶液
C
比较苯酚和乙酸的酸性
分别加入NOH溶液
D
比较AgCl和AgI的溶解度
向AgCl的饱和液中加少量KI溶液
难度: 中等查看答案及解析
-
强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、
C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
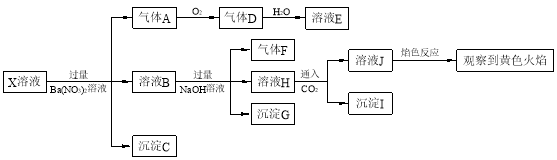
下列结论正确的是
A.X中不能确定的离子是 A13+、Na+、K+和C1-
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
难度: 困难查看答案及解析
-
被称为万能还原剂的NaBH4溶于水并和水发生反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A.NaBH4是氧化剂,H2O是还原剂
B.被氧化的元素与被还原的元素质量比为1︰1
C.硼元素被氧化,氢元素被还原
D.NaBH4既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有SO42-和N4H44+两种离子,当N4H44+遇到碱性溶液时,会生成N4分子。下列说法正确的是
A.14N、N4与N2互为同位素
B.N4H4(SO4)2的电离方程式为N4H4(SO4)2
N4H44++2 SO42-
C.N4H4(SO4)2不能与草木灰、K3PO4等化肥混合施用
D.N4H4(SO4)2中只含有共价键,不含离子键
难度: 中等查看答案及解析
-
能正确表示下列反应的离子反应方程式为
A.大理石溶于醋酸溶液: CaCO3 + 2H+==Ca2+ + CO2 ↑+ H2O
B.向FeBr2溶液中通入足量氯气:2Fe2+ + 4Br- + 3Cl2=== 2Fe3+ + 2Br2 + 6Cl-
C.NH4HCO3溶于过量的NaOH溶液中: HCO3- + OH- === CO32- + H2O
D.向明矾(KAl(SO4)2·12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3+ + 3SO42- + 3Ba2+ + 6OH-=== 2Al(OH)3↓ + 3BaSO4↓
难度: 中等查看答案及解析
-
将下图中所示实验装置的K闭合,下列判断正确的是
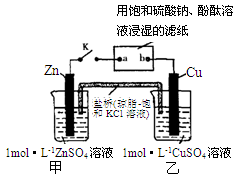
A.电子沿Zn→a→b→Cu路径流动
B.Cu电极上发生氧化反应
C.甲池与乙池中的溶液互换,闭合K仍有电流产生
D.片刻后可观察到滤纸a点变红色
难度: 中等查看答案及解析
-
下列装置所示的实验不能达到目的的是
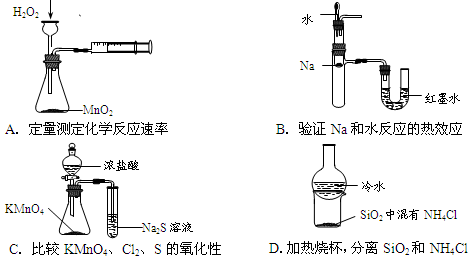
难度: 中等查看答案及解析
-
下列各种溶液中通入足量的SO2后,既无沉淀又无气体产生的是
①NaClO ②C6H5ONa ③Na2S ④BaCl2 ⑤Ba(OH)2 ⑥H2O2
A.①④⑥ B.①②③ C.④⑤⑥ D.①④⑤⑥
难度: 简单查看答案及解析
-
下列现象或事实不能用同一原理解释的是
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
难度: 简单查看答案及解析
-
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
A.由反应可确定:氧化性HClO3>O2
B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
C.由非金属性Cl>S,可推知酸性HClO3>H2SO4
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
难度: 中等查看答案及解析