-
某些建筑材料含有放射性元素氡(86222Rn),会对人体产生一定危害.该原子中中子数和质子数之差是( )
A.136
B.50
C.86
D.222难度: 中等查看答案及解析
-
一种“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
A.浓硫酸与水
B.生石灰与水
C.熟石灰与水
D.氯化钠与水难度: 中等查看答案及解析
-
下列说法正确的是( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果难度: 中等查看答案及解析
-
下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电难度: 中等查看答案及解析
-
某主族元素R的第五电子层上只有一个电子,下列描述正确的是( )
A.其单质在常温下跟水的反应不如钠剧烈
B.其原子半径比钾离子半径小
C.其碳酸盐易溶于水
D.其氢氧化物不能使氢氧化铝溶解难度: 中等查看答案及解析
-
X、Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素阳离子半径;Z和Y两元素的原子最外层电子数相同,Z元素的原子半径大于Y元素的原子半径,X、Y、Z三种元素原子序数的关系是( )
A.X>Y>Z
B.Y>X>Z
C.Z>X>Y
D.Z>Y>X难度: 中等查看答案及解析
-
实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是( )
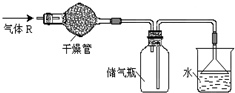
A.HCl
B.Cl2
C.CO
D.NH3难度: 中等查看答案及解析
-
下列关于化学键的叙述正确的是( )
A.两个原子之间的相互作用叫化学键
B.化学键既存在于相邻原子之间,又存在与相邻分子之间
C.化学键通常指的是相邻的两个或多个原子之间的强相互作用
D.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小难度: 中等查看答案及解析
-
共价键都有键能之说,键能是指拆开1mol共价键需要吸收的能量或者形成1mol共价键所放出的能量.如H-H键的键能是436kJ/mol,H-Cl键的键能是431kJ/mol,Cl-Cl键的键能是247kJ/mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJ
B.179kJ
C.89.5kJ
D.以上说法都不对难度: 中等查看答案及解析
-
对于达到平衡状态的可逆反应:N2+3H2
2NH3,下列有关叙述正确的是( )
A.反应物和生成物浓度不再发生变化
B.反应物和生成物的浓度相等
C.N2和NH3的质量分数相等
D.正反应和逆反应不再进行难度: 中等查看答案及解析
-
A元素的最高正化合价和负化合价的绝对值之差为6,B元素和A元素的原子次外层上的电子数均为8,A与B可形成化合物BA2,则该化合物是( )
A.MgCl2
B.CaF2
C.SiO2
D.CS2难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )

A.反应的化学方程式为:2M⇌N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍难度: 中等查看答案及解析
-
X、Y、Z三种元素的核电荷数在1~20之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.元素的得电子能力:X<Y<Z
B.气态氢化物的稳定性:按X、Y、Z顺序变大
C.含氧酸的酸性:H3ZO4>H2YO4>HXO4
D.元素负化合价的绝对值:按X、Y、Z顺序变大难度: 中等查看答案及解析
-
下列说法正确的是( )
A.Si02既不溶于水也不溶于任何酸
B.硫酸滴入水玻璃中可以得到硅酸
C.钢化玻璃能经受温度剧变,且能抵抗碱的腐蚀
D.因为温度高时SiO2与Na2CO3反应放出CO2,所以硅酸酸性比碳酸酸性强难度: 中等查看答案及解析
-
在一密闭容器中进行如下反应2SO2(g)+O2(g)
2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
A.SO2、O2浓度分别为0.4mol/L、0.2mol/L
B.SO3浓度为0.4mol/L
C.SO3浓度为0.25mol/L
D.SO3、SO2浓度均为0.15mol/L难度: 中等查看答案及解析
-
已知HCl难溶于CCl4.则如下图所示装置中,不适宜于HCl气体尾气吸收的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
把3molA和2.5molB混合盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气)⇌xC(气)+2D(气)
经过5min后达到平衡,生成1mol D,测得C的平均生成速率为0.10mol•L-1•min-1.下列叙述正确的是( )
A.A的平均消耗速率为0.32mol•L-1•min-1
B.升高温度可使反应速率加快
C.x的值为3
D.B的平衡浓度为2mol•L-1难度: 中等查看答案及解析
-
周期表中关于主族元素性质的叙述中不正确的是( )
A.主族序数等于原子最外层电子数
B.主族元素最高正价等于最外层电子数
C.第n主族元素其最高正价为+n价,负价绝对值为8-n(n≥4)
D.第n主族元素其最高价氧化物对应的化学式为R2On,氢化物化学式为RHn(n≥4)难度: 中等查看答案及解析