-
诗句“春蚕到死丝方尽,蜡烛成灰泪始干”中“丝”和“泪”分别指( )
A.蛋白质、烃类
B.纤维素、油脂
C.淀粉、油脂
D.蛋白质、硬化油难度: 中等查看答案及解析
-
宇航员在升空、返回或遇到紧急情况时,必须穿上10公斤重的舱内航天服,神六宇航员所穿舱内航天服是由我国科学家近年来研制的新型“连续纤维增韧”航空材料做成,其主要成风是由碳化硅、陶瓷和碳纤维复合而成的,下列相关叙述错误的是( )
A.它耐高温,抗氧化
B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点
D.它是一种新型无机非金属材料难度: 中等查看答案及解析
-
欧洲科学家小组将62Ni和208Pb经核聚合并紧接着释放出一个中子而产生了第110号元素的一种同位素,该同位素的中子数是( )
A.161
B.160
C.159
D.158难度: 中等查看答案及解析
-
13.8g 63%的HNO3溶液密度为1.38g•cm-3和100mL 13.8mol/L的HNO3溶液相比,正确的是( )
A.都应用棕色广口瓶存储
B.浓度不同的两种HNO3(aq)
C.溶液的体积不同但浓度相同
D.均可与Au反应而发生钝化现象难度: 中等查看答案及解析
-
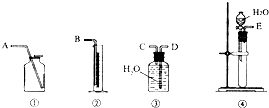
下列实验操作中错误的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水
C.为加速固体物质的溶解常采取搅拌、加热等措施
D.使用pH试纸测量溶液的酸碱性时,先把pH试纸用蒸馏水湿润后,再测量难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.100mL1mol/LFeCl3溶液中含阳离子数为0.1NA
B.常温常压下1molNO2气体与水反应生成NA个NO3-离子
C.0.6gCaCO3与Mg3N2的混合物中所含质子数为0.3NA
D.80mL10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA难度: 中等查看答案及解析
-
类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证.以下类推的结论正确的是( )
A.由甲酸可以发生银镜反应可推出其余的羧酸也均能发生银镜反应
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.Na、K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应难度: 中等查看答案及解析
-
半导体工业用石英砂做原料通过三个重要反应生产单质硅SiO2(s)+2C(s)═Si(s)+2CO(g),△H=682.44kJ/mol,
(石英砂) (粗硅)
Si(s)+2Cl2(s)═SiCl4(g),△H=-657.01kJ/mol,SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s),△H=-625.63kJ/mol
(粗硅) (纯硅)
,生产1.00kg纯硅的总反应热为( )
A.2.43×104kJ
B.-2.35×104kJ
C.-2.23×104kJ
D.-2.14×104kJ难度: 中等查看答案及解析
-
下表为元素周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )
A B C D E
A.A与B形成的阴离子可能有:AB32-、A2B42-
B.E的氢化物的沸点比C的氢化物的沸点高
C.D在过量的B中燃烧的主要产物为DB3
D.这5种元素形成只含极性键的非极性分子多于5种难度: 中等查看答案及解析
-
鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾.现有鸦片的替代品用于脱瘾治疗,结构如下:1mol该化合物完全燃烧耗O2的物质的量、与NaOH溶液作用消耗NaOH的物质的量、其苯环上的一溴代物的种数分别是( )

A.26mol、4mol、7mol
B.24mol、4mol、8mol
C.26mol、5mol、7mol
D.24mol、5mol、8mol难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.将0.1mol/LHCl溶液数滴缓缓滴入1mol/L50mLNa3PO4溶液中,且不断搅拌3H++PO43-=H3PO4
B.将1mol/LNaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
C.向1mol/L明矾溶液50mL中滴入数滴0.1mol/LBa(OH)2溶液Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓
D.将少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+难度: 中等查看答案及解析
-
在10mL0.1mol•L-NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系正确的是( )
A.c(Na+)>c(Ac-)>c(H+)>c(OH-)
B.c(Na+)=c(Ac-)>c(OH-)=c(H+)
C.c(OH-)=c(H+)+c(HAc)
D.2c(Na+)+c(H+)=2c(Ac-)+c(OH-)+c(HAc)难度: 中等查看答案及解析
-
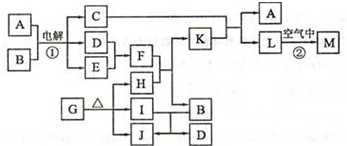
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
下列有关说法中不正确的是( )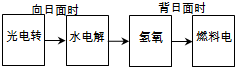
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阴极反应:O2+2H2O+4e-=4OH-
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O难度: 中等查看答案及解析
-
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)
aZ(g).此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于VL难度: 中等查看答案及解析