-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物难度: 中等查看答案及解析
-
19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说
B.发现元素周期律
C.提出分子学说
D.发现氧气难度: 中等查看答案及解析
-
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为不正确的是( )
A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
B.将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同难度: 中等查看答案及解析
-
美国劳伦斯在2006年10月16日宣布,实验室科研人员与俄罗斯科学家合作,利用俄方的回旋加速器设备,成功合成了某种物质,其中发现了第118号( )
A.原子
B.分子
C.核素
D.元素难度: 中等查看答案及解析
-
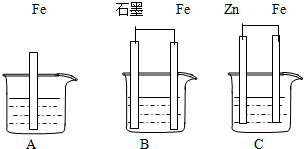
如图所示装置,能够组成原电池且产生电流的是( )
A.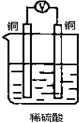
B.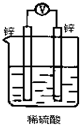
C.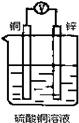
D.
难度: 中等查看答案及解析
-
下列表达方式不正确的是( )
A.四氯化碳
B.氟化钠的电子式
C.硫离子的结构示图
D.碳-12原子612C难度: 中等查看答案及解析
-
下列说法中一定不正确的是( )
A.某些花岗岩会产生氡(86222Rn),从而对人体产生伤害,86222Rn的质量数是222
B.Se是人体必需的微量元素,3478Se和3480Se互为同位素
C.613C-NMR(核磁共振)可以用于含碳化合物的结构分析,613C的中子数为6
D.92235U的浓缩一直为国际社会关注,92235U与92238U是两种不同的核素难度: 中等查看答案及解析
-
下列物质中,本身所具有的能量最高的是( )
A.氟化氢
B.氯化氢
C.溴化氢
D.碘化氢难度: 中等查看答案及解析
-
关于元素周期表和元素周期律的应用有如下叙述:①元素周期表是同学们学习化学知识的一种重要工具;②利用元素周期表可以预测新元素的原子结构和性质;③利用元素周期表和元素周期律可以预言新元素;④利用元素周期表可以指导寻找某些特殊的材料.其中正确的是( )
A.只有②③
B.只有②③④
C.只有③④
D.①②③④难度: 中等查看答案及解析
-
“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观像冰.1体积“可燃冰”可贮载100~200体积的天然气.下面关于“可燃冰”的叙述不正确的是( )
A.“可燃冰”的主要可燃成分是甲烷
B.“可燃冰”提供了水可能变成油的例证
C.“可燃冰”有可能成为人类未来的重要能源
D.“可燃冰”是一种比较洁净的能源难度: 中等查看答案及解析
-
下列有关原子核外电子的说法错误的是( )
A.在含有多个电子的原子里,电子分别在能量不同的区域内运动
B.电子总是尽可能地先从内层排起,当一层充满后再填充下一层
C.每个电子层作为最外层时,最多可容纳8个电子
D.离原子核近的电子能量低,离原子核远的电子能量高难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.甲烷与二氯甲烷的分子结构相同,都是正四面体结构
B.烷烃同系物随着碳原子数的增多,一般熔沸点逐渐升高
C.正丁烷的沸点高于异丁烷的沸点
D.可以用分液的方法将水与己烷的混合物分离且从分液漏斗下层分离出的液体是水难度: 中等查看答案及解析
-
下列各组物质中,互为同分异构体的是( )
A.O2和O3
B.11H和12H
C.CH4和CH3CH3
D.和CH3-CH2-CH2-CH3
难度: 中等查看答案及解析
-
下列各组物质中化学键的类型完全相同的是( )
A.NH3 H2O CO2
B.H2O Na2O CO2
C.CaCl2 NaO HH2O
D.HCl MgCl2 NH4Cl难度: 中等查看答案及解析
-
下列关于化学反应限度的说法中不正确的是( )
A.在给定条件下,当一个可逆反应达到平衡状态时,就是这个反应所能达到的限度
B.可逆反应达到平衡状态较快,说明化学反应速率快,所以不能通过延长化学反应的时间来改变反应的限度
C.改变反应条件,可以在一定程度上改变一个化学反应的限度
D.当一个可逆反应达到平衡状态时,各组分浓度不变,υ(正)=υ(逆)=0难度: 中等查看答案及解析
-
下列递变规律正确的是( )
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的还原性依次增强
C.Al3+、Mg2+、F-粒子的半径依次减小
D.K、Rb、Cs最高正价依次降低难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.共价化合物中一定不含离子键,离子化合物中一定不含共价键
B.两种元素组成的化合物中一定不含非极性键
C.离子化合物在溶于水和熔融态时都能导电,有些共价化合物在溶于水时导电,但在液态时不能导电
D.非金属元素组成的化合物,一定是共价化合物难度: 中等查看答案及解析
-
燃料电池是目前电池研究的热点之一.现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极.下列叙述不正确的是( )

A.a电极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-=4H2O
C.总反应方程式为2H2+O2=2H2O
D.使用过程中电解质溶液的pH逐渐减小难度: 中等查看答案及解析
-
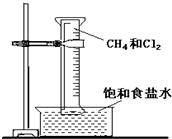
下列反应属于取代反应的是( )
A.CH4+Cl2CH3Cl+HCl
B.CH3CH2OHCH2═CH2↑+H2O
C.CH4+2O2CO2+2H2O
D.CH2=CH2+H2CH3-CH3
难度: 中等查看答案及解析
-
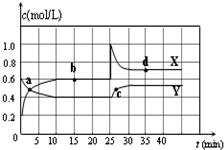
把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(气)+Y(气)=nZ(气)+2W(气).5min末已生成0.2molW,若测知以Z浓度变化来表示的化学反应平均速率为0.01mol•L-1•min-1,则上述反应中Z气体的计量系数 n的值是( )
A.1
B.2
C.3
D.4难度: 中等查看答案及解析