-
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素中子数与核外电子数之差是( )
A.57 B.47 C.61 D.293
难度: 简单查看答案及解析
-
元素性质呈周期性变化的原因是 ( )
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.原子核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
难度: 简单查看答案及解析
-
氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中( )
A.75.77%表示35Cl的质量分数 B.24.23%表示35Cl的丰度
C.35. 453表示氯元素的相对原子质量 D.36.966表示37Cl的质量数
难度: 中等查看答案及解析
-
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材料K3C60
难度: 中等查看答案及解析
-
下列气态氢化物最稳定的是( )
A.CH4 B.O H3 C.H2O D.HF
难度: 简单查看答案及解析
-
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为( )
A.HX B.H2X C.XH4 D.XH3
难度: 中等查看答案及解析
-
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.第16列元素的最高价氧化物的化学式为RO3
B.第2列元素中一定没有非金属元素
C.第15列元素的最高价氧化物对应的水化物的化学式可能为H3RO4
D.某元素的离子最外层电子数与次外层相同,该元素一定位于第三周期
难度: 困难查看答案及解析
-
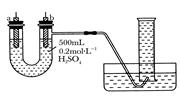
一种新型熔融盐燃料电池具有高发电效率。现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2。则下列说法中正确的是 ( )
A.通CO的一极是电池的正极
B.负极发生的电极反应是:O2+2CO2+4e-―→2CO
C.负极发生的电极反应是:CO+CO
-2e-―→2CO2
D.正极发生氧化反应
难度: 困难查看答案及解析
-
在密闭系统中有反应C(s)+CO2(g)
2CO(g),能使反应速率加快的措施是( )
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎
④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2
A.①②③⑥ B.①②④⑥
C.①②③④ D.①②③④⑤
难度: 困难查看答案及解析
-
下列物质含有的化学键类型相同的是( )
A.NaBr和H2O B.Na2O和Na2O2 C.D2O和CO2 D.NH4Cl和HCl
难度: 中等查看答案及解析
-
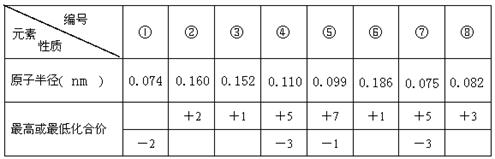
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
难度: 困难查看答案及解析
-
下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的碳原子的符号:12C B.NaCl的电子式:
C.Cl—的结构示意图:
D.CH4分子的比例模型:
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸的反应 B.氢氧化钡晶体与氯化铵晶体的反应
C.甲烷在氧气中的燃烧反应 D.灼热的碳与二氧化碳的反应
难度: 中等查看答案及解析
-
已知断开1 mol H2中的化学键需要吸收436kJ的能量,断开1 mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为( )
A.吸收183kJ B.吸收366kJ C.放出183kJ D.放出366kJ
难度: 中等查看答案及解析
-
用铁片稀H2SO4反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.不用稀H2SO4改用98%的浓H2SO4
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
难度: 中等查看答案及解析
-
反应3X(g)+Y(g)
Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( )
A.V(Y)=0.02mol·L—1·min—1 B.V(Z)=0.10mol·L—1·min—1
C.V(X) =0.03mol·L—1·min—1 D.V(W)=0.02mol·L—1·s—1
难度: 中等查看答案及解析
-
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
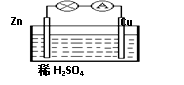
①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn-2e-=Zn2+ ④溶液中H+向Zn棒迁移
A.①② B.①②③
C.②③④ D.①②③④
难度: 中等查看答案及解析
-
在一定条件下,向某容器中充入N2和H2合成NH3,以下叙述错误的是( )
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后减小为零
C.随着反应的进行,逆反应速率逐渐增大,最后保持恒定
D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A.16O、18O互为同位素
B.金刚石和石墨互为同素异形体
C.分子式符合通式CnH2n+2 且 n 值不同的两种烃互为同系物
D.
 互为同分异构体
互为同分异构体难度: 中等查看答案及解析
-
制取一氯乙烷最好采用的方法是( )
A.乙烷和氯气反应 B.乙烯和氯气反应
C.乙烯和氯化氢反应 D.乙烯和氢气反应后再和氯气反应
难度: 中等查看答案及解析
-
1 mol乙烯与氯气发生完全加成反应,然后使该加成产物与氯气在光照条件下发生完全取代反应,则两个过程中消耗氯气的总物质的量是( )
A.3 mol B.4 mol C.5 mol D.6 mol
难度: 中等查看答案及解析
-
将30 g CH4和C2H4的混合气体通入盛有足量溴水的容器中,溴水的质量增加了14 g,则混合气体中CH4和C2H4的体积之比为( )
A.1∶2 B.2∶1 C.3∶2 D.2∶3
难度: 中等查看答案及解析
-
分子式为C5H11Cl的同分异构体共有(不考虑立体异构)
A.6种 B.7种 C.8种 D.9种
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.含有极性键的分子一定是极性分子
C.含有金属离子的晶体一定是离子晶体
D.元素的非金属型越强,其单质的活泼型一定越强
难度: 中等查看答案及解析
-
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是 ( )
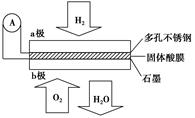
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-―→4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
难度: 中等查看答案及解析
-
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法不正确的是 ( )
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液PH不断升高
A.①② B.①③ C.①④ D.③④
难度: 困难查看答案及解析
-
可逆反应mA(g)+nB(g)
pC(g)+gD(g)的v-t图象如下图甲,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如下图乙。( )
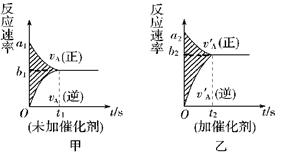
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2
⑦两图中阴影部分面积相等 ⑧乙图阴影部分面积更大,以上正确的为( )
A.①③⑥⑦ B.①④⑥⑧ C.②③⑤⑧ D.②④⑤⑦
难度: 困难查看答案及解析
-
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)
2C(g)达平衡时的特征的是( )
(1)C的生成速率与C的分解速率相等;(2)单位时间内生成amol A,同时生成3amolB;
(3)A、B、C的浓度不再变化; (4)A、B、C的压强不再变化;
(5)混合气体的总压不再变化; (6)混合气体的物质的量不再变化;
(7)单位时间内消耗amolA,同时生成3amolB;(8)A、B、C的分子数之比为1:3:2。
A (3)(8) B.(1)(6) C(2)(4) D.(2)(8)
难度: 困难查看答案及解析
-
下列结论错误的是( )
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-) ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.① B.①③ C.②③④⑤⑥⑦ D.①③⑤
难度: 困难查看答案及解析
-
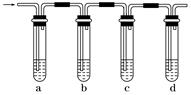
下列与金属腐蚀有关的说法正确的是( )

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
难度: 中等查看答案及解析