-
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
A. Fe与浓盐酸反应比与稀盐酸反应快
B. Cu与浓硝酸反应比与稀硝酸反应快
C. N2与O2在常温、常压下不反应,放电时可反应
D. Cu能与浓硝酸反应,但不能与浓盐酸反应
难度: 中等查看答案及解析
-
已知在25℃,101kPa下,1gC8H28(辛烷)燃烧生成二氧化碳和液态水时放出48.4kJ热量.表示上述反应的热化学方程式正确的是
A. C8H28(l)+
O2(g)===8CO2(g)+9H2O(l) △H=-5517.6 KJ·mol—1
B. C8H28(l)+
O2(g)===8CO2(g)+9H2O(l) △H=-48.4 KJ·mol—1
C. C8H28(l)+
O2(g)===8CO2(g)+9H2O(l) △H=+5517.6 KJ·mol—1
D. C8H28(l)+
O2(g)===8CO2(g)+9H2O(l) △H=+48.4 KJ·mol—1
难度: 中等查看答案及解析
-
下列现象与电化学腐蚀无关的是
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比纯铁容易生锈
C. 铁质器件附有铜质配件在接触处易生锈
D. 银制奖牌久置后表面变暗
难度: 中等查看答案及解析
-
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下面有关电池的叙述正确的( )
A. 锌锰干电池工作段时间后碳棒变细
B. 氢氧燃料电池可将热能直接转变为电能
C. 氢氧燃料电池工作时氢气在负极被氧化
D. 太阳能电池的主要材料是高纯度的二氧化硅
难度: 简单查看答案及解析
-
在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是
A. 正极附近的SO42—离子浓度逐渐增大
B. 电子通过导线由铜片流向锌片
C. 铜片上有H2逸出
D. 正极有O2逸出
难度: 中等查看答案及解析
-
能源与人类的生活和社会发展密切相关,下列关于能源开发和利用的说法中,你认为说法不正确的是
A. 充分利用太阳能
B. 因地制宜开发利用风能、水能地热能、潮汐能
C. 能源都是通过化学反应获得的
D. 合理、安全开发利用氢能、核能
难度: 中等查看答案及解析
-
“暖宝宝取暖片的材料中含有铁粉、水、活性炭、硅石、食盐等它们组成一个原电池在反应时释放出热量,铁粉在原电池中充当
A. 正极 B. 负极 C. 阴极 D. 阳极
难度: 中等查看答案及解析
-
下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥食物腐败
A. ②③④⑤⑥ B. ②③④ C. ②⑤⑥ D. ①③⑤
难度: 简单查看答案及解析
-
化学反应4A(s)+3B(g)
2C(g)+D(g),经2 min,B的浓度减少0.6 mol/L。对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4 mol·(L·min)-1
B. 分别用B、C、D表示的反应速率其比值是3∶2∶1
C. 2 min末的反应速率用B表示是0.3 mol·(L·min)-1
D. 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的
难度: 中等查看答案及解析
-
某反应的反应过程中的能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列有关叙述中正确的是
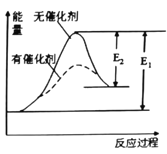
A. 上图可表示由KClO3加热制O2反应过程中的能量变化
B. 催化剂能改变该反应的焓变
C. 催化剂能改变该反应的正反应的活化能而对逆反应的活化能无影响
D. 该反应为放热反应
难度: 中等查看答案及解析
-
在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )

A. 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B. 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C. 在D点:c(HCOO-)+c(HCOOH)>2c(K+)
D. B→C段:水的电离程度先增大后减小
难度: 困难查看答案及解析
-
茫茫黑夜中,航标灯为航海员指明了方向航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中
①铝合金是阳极②铝合金是负极③海水是电解液④铝合金电极发生还原反应
A. ②④ B. ②③ C. ①② D. ①④
难度: 中等查看答案及解析
-
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4,下列图中表示其产生品总体积(V)与时间(t)的关系正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
把A、B、C、D四块金属泡在稀HSO4中用导线两两相连可以组成各种原电池.若A、B相连时,A为负极:C、D相连,D上有气泡逸出;A、C相连时A极减轻:B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为
A. A>C>B>D B. A>C>D>B C. B>D>C>A D. A>B>>C>D
难度: 中等查看答案及解析




